Доступ мерседес к печени
Обновлено: 05.07.2024
ОПЕРАТИВНЫЕ ДОСТУПЫ К ПЕЧЕНИ
• Доступ Кохера (1888). Применяется для обнажения правой доли печени, внепеченочных желчных путей и пузыря. Разрез проводится от верхушки мечевидного отростка параллельно правой половине реберной душ на 2 поперечных пальца ниже ее. При этом пересекаются прямая и широкие мышцы живота, межреберные нерпы и сосуды. При высокой травматичности доступ Кохера не всегда дает достаточный простор в ране.
• Доступ С.П. Федорова. Разрез ведется от мечевидного отростка отвесно вниз на протяжении 5 см, после чего сворачивает к правой реберной дуге и ведется параллельно ей.
• Доступ Рио Бранко (1912). Малотравматичный и широкий доступ Рио-Бранко состоит из двух частей. Вертикальная часть проводится по белой линии живота, а косая — по ходу волокон наружной косой мышцы живота.
• Доступ типа «Мерседес» – два субкостальных разреза, дополненные верхнесрединной лапаротомией в виде трехлучевой звезды применяется при больших операциях на печени, ее трансплантации.
1 – верхняя срединная лапаротомия,
4 – по Рио-Бранко,
Торакофреноабдоминальные доступы.
К этой группе относятся доступы, при которых сначала вскрывается грудная, а потом брюшная полость.
• Доступ Куино (1954). Проводится от нижнего угла правой лопатки по VII межреберью до пупка. Вскрывается плевральная, брюшная полости и рассекается диафрагма. Этот доступ хорошо обнажает верхне-заднюю поверхность печени.
• Доступ С.А. Боровкова (1960, 1962). Разрез ведется от средней или задней подмышечной линии в VI, VII или VIII межреберье в зависимости от высоты стояния печени до средней линии живота на 2-4 см выше пупка. Рассекается правая реберная дуга и на протяжении 12-16 см диафрагма. Преимущество этот доступа возможность менять высоту торакального и абдоминальною отрезков доступа в зависимости от положения печени и локализации патологического процесса.
Абдоминофреноторакалъные доступы.
При этих доступах в начале вскрывается брюшная, а затем грудная полость.
• Доступ Ф.Г. Углова (1952). Верхняя поперечная лапаротомия, ревизия брюшной полости. Разрез продолжают по IX межреберью до задней подмышечной линии. При этом вскрывают плевральную полость и рассекают диафрагму. Этот доступ применяется при манипуляциях и области ворот печени и при резекции этого органа.
Стерномедиастинолапаротамия.
Применяется для подхода к левой доле печени. Верхняя срединная лапаротомия, ревизия верхнего этажа брюшной полости. Разрезом 6-7 см рассекаются мягкие ткани над грудиной, тупым путем разделяются волокна диафрагмы и отслаиваются листки медиальстинальной плевры. 11илкой Джильи или реберными ножницами грудина расщепляется в продольном направлении, обходя мечевидный отросток слева или после удаления ею хрящевой части.
5) Экстраплевральный доступ (Л.Ю. Созон-Ярошевич). Применяется в лечении гнойников задних отделом печени, когда инфицирование плеврального листка при рассечении его неизбежно. Разрез кожи длиной 15-16 см производится на 4-6 см выше правой реберной дуги параллельно ей соответственно нижнему краю правой плевры. Резекция двух ребер па протяжении 5-6 см. Обнажившийся плевральный синус тупо отсепаровывают от диафрагмы. Попадают в spatium praediaphragmaticum. Диафрагму подшивают к межреберным мышцам и рассекают параллельно линии кожного разреза. В ряде случаев приходится прибегать к чресплевральному доступу, впервые описанного Розером в 1864 и получившею признание после работ А.А. Гроянова (1891-1898). Этим доступом пользовался и В.Ф. Войно-Ясенецкий. При положении больного на здоровом боку на протяжении 12-14 см резецируют X ребро. В.Ф. Войно-Ясенецкий резецировал XI ребро или оба. Рассекают плевральный мешок, диафрагму и пиогенную оболочку.
Внебрюшинные доступы.
Резекция печени – операция удаления части печени.
Показания: злокачественные новообразования; травмы.
Существует два основных варианта выполнения этой операции.
Типичные резекции печени.
Первая типичная резекция печени была выполнена в 1939 году Манером Мейем и Тонг Тха Тунгом (была удалена левая доля печени по поводу первичной карциномы). Авторы назвали резекцию анатомической. Перевязка сосудов производилась внутри паренхимы печени, так как при перевязке желчно-сосудистых элементов в воротах печени мешает IV сегмент, зависящий от левой ножки. В 1965 году насчитывалось уже 1270 резекций печени, из которых только 198 можно было отнести к анатомическим, т.е. выполняемым с внутрипеченочной перевязкой глиссоновой ножки.
По определению В.Л. Журавлева «к типичной (анатомической) резекции относятся операции, выполненные воротным или фиссуральньм способом после предварительной перевязки сосудов и протоков в портальных и кавальных воротах печени».
Разделение паренхимы печени производится по клетчаточным щелям. Сосудисто-секреторные элементы перевязываются в воротах органа. Учитываются особенности интра- и экстраорганных структур печени.
По объему выделяют следующие виды типичных резекций:
- гемигепатэктомия (удаление половины печени)
- лобэктомия (удаление доли)
- сегментэктомия (удаление сегмента)
- расширенная резекция (удаление двух или более расположенных рядом анатомических частей)
В любой типичной резекции печени можно выделить пять основных моментов.
Хирургические доступы к печени, желчному пузырю и желчным протокам
Для обнажения печени, желчного пузыря и желчных протоков предложено свыше 30 хирургических доступов. Эти доступы можно разделить на три группы: передние, задние и верхние.
Передние доступы наиболее многочисленны; их можно подразделить на косые, вертикальные и угловые (рис. 562).


562. Схема разрезов, применяемых при операциях на печени, желчном пузыре и желчных путях.
1 — косой разрез (Кохер); 2 — косой разрез (С. П. Федоров); 3 — углообразный разрез (Рио-Бранко); 4 — волнообразный разрез (Кер); 5 — волнообразный разрез (Бивен); 6 — верхний срединный разрез; 7 — трансректальный разрез; 8 — параректальный разрез; 9 — торакоабдоминальный разрез (Райфершайд); 10 — торакоабдоминальный разрез (Ф. Г. Углов); 11 — торакоабдоминальный разрез (Кунео); 12 — лоскутный разрез (Бруншвиг); 13 — углообразный разрез (Черни); 14 — торакоабдоминальный разрез (Райфершайд); 15 — торакоабдоминальный разрез (Киршнер); 16,17 — торакоабдоминальный разрез (Райфершайд).
К косым разрезам передней брюшной стенки относятся следующие: разрезы Кохера (Kocher), С. П. Федорова, Прибрама (Pribram), Шпренгеля (Sprengel) и др. Особенно широкое распространение получили разрезы Кохера и С. П. Федорова, так как они создают наиболее прямой путь и наилучший доступ к желчному пузырю, желчным протокам и нижней поверхности печени.
Разрез Кохера начинают от срединной линии и проводят на 3—4 см ниже и параллельно реберной дуге; длина его 15—20 см.
Разрез по С. П. Федорову начинают от мечевидного отростка и проводят вначале книзу по срединной линии на протяжении 3—4 см, а затем параллельно правой реберной дуге; длина его 15—20 см.
К вертикальным разрезам передней брюшной стенки относятся: верхний срединный, параректальный и трансректальный.
Из этой подгруппы наиболее часто пользуются срединным разрезом, проведенным между мечевидным отростком и пупком. При недостаточности этого доступа его можно расширить, произведя дополнительный правый поперечный разрез.
Параректальный разрез Лоусон Тейта (Lawson Tait) и трансректальный разрез О. Э. Гаген-Торна применяют редко, хотя некоторые клиники отдают им предпочтение (В. А. Жмур).
Угловые и волнообразные разрезы — Кера (Kehr), Бивена (Bevan), Рио-Бранко (Rio-Branсо), Черни (Czerny), В. Р. Брайцева, Мейо-Робсона (Mayo-Robson), A. M. Калиновского и др. — дают свободный доступ к желчным протокам и печени и находят широкое применение.
Из этой подгруппы разрезов чаще других применяют разрез Рио-Бранко, который проводят по срединной линии от мечевидного отростка вниз и, не доходя на два поперечных пальца до пупка, поворачивают вправо и вверх к концу X ребра.
Широкое обнажение печени обеспечивают торакоабдоминальные доступы Ф. Г. Углова, Киршнера (Kirschner), Бруншвига (Brunschwig), Райфершайда (Reiferscheid) и др.
Задние (поясничные) доступы А. Т. Богаевского, Н. П. Тринклера применяются главным образом при повреждениях, кистах или абсцессах задней поверхности печени.
Верхние доступы: внеплевральный А. В. Мельникова и чресплевральный Фолькмана-Израэля (Folcman, Israel) применяют для обнажения верхнезаднего отдела диафрагмальной поверхности печени (рис. 563, 564). Этими доступами пользуются при операциях по поводу абсцессов, кист и поврежденний печени.
Оперативные доступы в хирургии печени
Доступы для осуществления оперативных вмешательств на печени играют существенную роль, облегчая или затрудняя обзор и действия хирурга. С развитием анестезиологии и применения миорелаксантов вопрос о большей целесообразности того или иного доступа несколько утратил свою остроту, так как возможности современной анестезиологии позволяют широкое разведение раны в условиях миорелаксации.
Тем не менее рациональный доступ открывает достаточный обзор операционного поля и дает возможность легче выполнить ту или иную манипуляцию на печени. Особенно важен рациональный доступ при проведении больших вмешательств (обширные резекции органа), когда по ходу операции возникает необходимость своевременного предупреждения осложнений или борьбы с уже развившимися осложнениями.
Большинство хирургов для операций на печени пользуются трансабдоминальными доступами. Эти доступы имеют свои преимущества и недостатки. Их преимущества — малая травматичность и привычка большинства хирургов, которая определяет стереотип доступа и его детальную техническую разработанность. Среди недостатков — неполный обзор правой половины печени.
Анатомические исследования С.А. Боровкова (1962) клинические наблюдения И.Л. Брегадзе (1963), B.C. Шишкина (1970), а также ряда зарубежных исследователей позволяют полагать, что трансабдоминальные доступы не всегда пригодны для крупных вмешательств на печени.
При проведении ревизии из абдоминального доступа, особенно если он осуществляется в условиях местного обезболивания или недостаточной релаксации, возможны грубые диагностические ошибки — следствие того, что хирург не может осуществить полноценную ревизию правых отделов печени и поддиафрагмального пространства.
Еще более серьезный недостаток — ограниченный доступ к глиссоновым и особенно кавальным воротам органа. При осуществлении обширных резекций печени, удалении участков VII—VIII сегментов печени и особенно при развитии интраоперационных осложнений действия хирурга при трансабдоминальном подходе ограничены малым углом операционного действия и значительной глубиной раны при ее малых размерах.
Чрезвычайно усложняются манипуляции хирурга при необходимости работы на задних отделах диафрагмальной поверхности печени, в зоне печеночных вен и нижней полой вены. Если при этом операционное поле заливается кровью, то положение хирурга может оказаться весьма сложным.
Многие хирурги на основании топографо-анатомических исследований или большого опыта считают целесообразным для больших операций на печени применение торако-абдоминального доступа.

Торакофренолапаротомия по Куино
При многих достоинствах торако-абдоминальных доступов все они имеют существенный недостаток — значительную травматичность. Обеспечивая свободу манипуляций хирурга в зоне ворот печени и печеночных вен, они небезопасны даже в условиях современного обезболивания. Кроме того, дополнительное вскрытие плевральной полости во время вмешательства чревато возможностями инфицирования последней при операциях по поводу гнойных процессов, нагноившегося эхинококкоза и распадающегося альвеококкоза.
При операциях по поводу опухолей и паразитарных поражений печени возникает опасность обсеменения плевральной полости опухолевыми клетками и паразитарными элементами (сколексами).
Для объективной оценки оперативных доступов А.Ю. Сазон-Ярошевичем (1954) и его школой были разработаны критерии оперативных доступов: ось оперативного действия (направление оси операционного действия и наклонение оси операционного действия), глубина раны, угол операционного действия, зона доступности.
Под направлением оси операционного действия мыслится линия, соединяющая глаз хирурга с наиболее глубокой точкой операционной раны или наиболее важным объектом вмешательства. По этому направлению передвигаются инструменты и руки хирурга. Направление оси операционного действия определяют по отношению к координатам тела человека (плоскостям) и горизонтальной плоскости. По направлению оси операционного действия хирург должен представить себе те ткани, которые он будет последовательно разделять, чтобы открыть объект операции и видеть его.
Наклонение оси операционного действия — угол, образованный осью операционного действия и поверхностью тела больного в пределах операционной раны. Условно эта поверхность называется плоскостью раны. Это угол зрения, под которым хирург вынужден рассматривать объект операции. Наилучшие условия для операции создаются, если этот угол равен 90°.
Глубина раны определяется после того, как поставлены ранорасширители, отстраняющие близлежащие органы от объекта операции. Измеряется глубина раны по оси операционного действия от плоскости апертуры разреза до объекта вмешательства. Чем глубже рана, тем труднее оперировать. При глубине раны 15—20 см операция затруднена и осуществляется с помощью специальных инструментов и особого освещения.
Угол операционного действия определяет возможности перемещения в ране инструментов и рук хирурга. Чем больше угол операционного действия, тем легче оперировать. При угле 90° операция идет так, как если бы орган лежал на поверхности. При величине угла 25° манипуляции осуществлять трудно, а при 10—14° они практически невозможны без специальных инструментов и освещения.
Зона доступности определяется, когда через узкую рану оперируют большой орган и кожная рана меньше площади дна раны. Зону доступности определяют в квадратных сантиметрах, и она характеризует качество доступа. Критерии оперативных доступов, разработанные школой Сазон-Ярошевича, в определенной степени объективизируют характеристики доступов.
Но операционный доступ — это не простое геометрическое понятие. При выборе доступа кроме этих характеристик необходимо учитывать ряд биологических и физиологических особенностей организма. Параметры доступа могут изменяться в зависимости от патологии органа, конституции больного и предыдущих оперативных вмешательств.
С введением в клиническую практику операций из мини-доступов и лапароскопических вмешательств эти критерии пересматриваются, но, несмотря на то что большие операции на печени начали осуществлять по лапароскопическим методикам, эти вмешательства пока единичны, и абсолютное большинство операций на печени в настоящее время осуществляют открытыми доступами.
Для доступа к левой половине печени многие хирурги пользуются верхней срединной лапаротомией. Ее возможности могут быть значительно расширены путем стерно-медиатинотомии.

Срединная лапаротомия со стернотомией
В клинике этот доступ успешно использовали и положительно оценили Б.А. Петров и И.В. Данилов (1960) и B.C. Шапкин (1962).
Доступ для операций на печени должен отвечать следующим требованиям.
• Малая травматичность с повреждением наименьшего числа межреберных нервов, пересечение которых приводит к атрофии мышц брюшной стенки.
• Достаточный обзор всей печени: правой и левой ее половин, области ворот и диафрагмальной поверхности, включая зону нижней полой вены и печеночных вен.
• Свободный доступ к глиссоновым и кавальным воротам печени.
• Удобство для дренирования в послеоперационном периоде.
В настоящее время большинство хирургов пользуются для больших операций на печени двумя доступами: скобовидный доступ и двухподреберный доступ типа «мерседес».
Скобовидный доступ отвечает всем приведенным выше требованиям и применяется на протяжении более чем тридцати лет. Автор считал его аналогичным предложенному М. Reifferscheid. И.М. Матяшин и A.M. Глузман в «Справочнике хирургических операций» (1979) описывают его как оригинальный, называя доступом Альперовича.
Оперативное вмешательство начинается со срединной лапаротомии от мечевидного отростка до пупка. Срединная лапаротомия позволяет провести предварительную ревизию органа и определить объем предстоящего вмешательства. Из этого доступа в большинстве случаев легко осуществить манипуляции на левой половине печени. В случае необходимости обзора всего органа разрез расширяют от пупка по направлению к восьмому межреберью, послойно рассекая ткани брюшной стенки. При этом не пересекаются межреберные нервы, а разрез превращается в лоскутный.
Лоскут брюшной стенки отводят вверх, после чего открывается обзор всей печени и свободный подход к глиссоновым и кавальным воротам органа. Обычно этот разрез удовлетворителен для осуществления любого вмешательства на печени. Если же по ходу операции возникает необходимость расширения доступа, то разрез по восьмому межреберью до угла лопатки легко можно превратить в торакоабдоминальный, обеспечивающий не только доступ к печени, но и подход к нижней полой вене выше диафрагмы через перикард.
Преимущества этого доступа — его малая травматичность, возможность ограничиться только абдоминальной частью разреза или срединной лапаротомией, что немаловажно при осуществлении вмешательств у тяжелых больных или при паллиативных операциях.
Многие хирурги в последние годы при осуществлении больших вмешательств на печени используют двухподреберный доступ типа «мерседес». Этот доступ позволяет хорошо реви-зировать всю печень и проводить манипуляции на воротах органа.

Двухподреберный доступ типа «мерседес»

Двухподреберный доступ. Вскрыта брюшная полость
Современный наркоз и использование совершенных ранорасширителей позволяют получить достаточный обзор глиссоновых и кавальных ворот печени и произвести любое вмешательство на печени. При необходимости этот разрез можно дополнить срединным разрезом вверх до мечевидного отростка.
Несмотря на большое число оперативных доступов к печени (М.М. Соловьев описывает 27 и считает, что их значительно больше), в действительности описанные доступы лучше других отвечают требованиям сегодняшнего дня и применяются чаще всего.
При необходимости подхода к диафрагмальной поверхности печени оптимальным считается доступ А.В. Мельникова.
В последние годы в связи с развитием малоинвазивных технологий и лапароскопической хирургии для вмешательств на печени стали применять мини-доступы. Они дают возможность из малых разрезов осуществлять необходимые манипуляции на печеночной ткани. Мини-доступы требуют применения специальных инструментов и определенных навыков хирурга. Они вполне обоснованы и целесообразны при удалении небольших очаговых образований, выходящих на поверхность органа (гемангиомы, кисты).
Такие доступы показаны при оперативных вмешательствах по поводу эхинококковых кист и абсцессов печени, когда малые разрезы делают над патологическим очагом, а современная техника позволяет рационально воздействовать на него. Преимуществами таких доступов являются малая травматичность, экономическая эффективность и возможность сокращения времени пребывания пациента в стационаре.
Лапароскопическая техника при оперативных вмешательствах по поводу очаговых образований печени стала широко применяться в последние десятилетия при оперативных вмешательствах по поводу эхинококкоза, гемангиом и абсцессов печени. Обязательное условие для осуществления подобных вмешательств — расположение патологического очага в зонах, доступных визуализации. Вылущивание небольших гемангиом в клинике успешно производили С.И. Емельянов (2000), Н.В. Мерзликин (2000), С.П. Штофин (2000).
Японские хирурги на международном конгрессе в Вене (1999) сообщили о резекции печени, произведенной с использованием видеолапароскопической техники.
При этом необходимо отметить, что использование мини-доступов и видеолапароскопической техники пока возможны лишь при небольших размерах патологических очагов в печени. Крупные вмешательства осуществимы только с использованием достаточных доступов, позволяющих манипулировать на глиссоновых и кавальных воротах органа и удалять значительные участки печеночной ткани (доли, половины печени).
Современное лечение метастазов в печень: можно ли обойтись без операции?
Метастазы в печень, вызванные опухолями других локализаций (метастатический рак печени, метастатическое поражение печени) встречаются гораздо чаще, чем злокачественные опухоли, развивающиеся из клеток печени (первичный рак печени). О том, как выглядит современная диагностика и лечение метастазов в печень - сегодняшний материал.
Откуда возникают метастазы в печень?
Метастазы в печень, как правило, являются гематогенными - распространяются с кровотоком от опухолей, располагающихся вблизи крупных кровеносных сосудов. После разрастания злокачественного новообразования в просвет вены или артерии, частицы опухоли начинают циркуляцию в организме. Печень - природный “фильтр”, в котором кровь очищается, замедляя скорость своего течения. Именно поэтому циркулирующие микрометастазы с высокой долей вероятности оседают в тканях органа, вызывая рост вторичной опухоли - метастаза в печени.
Какие опухоли чаще всего дают метастазы в печень?
Учитывая активную роль печени в фильтрации крови, она - распространенный “орган-мишень” для метастазов рака ряда локализаций
- рак поджелудочной железы;
- рак кишечника;
- рак желудка;
- рак молочной железы;
- рак пищевода.
Почти все из опухолей этих локализаций могут протекать скрытно даже на момент начала метастазирования, поэтому нередки случаи, когда метастазы в печень демонстрируют более выраженную симптоматику, чем первичная опухоль, и становятся поводом обращения к врачу. При обнаружении опухолевого процесса в печени, еще до проведения морфологического исследования с целью выявления типа опухолевых клеток, из которых состоит новообразование, врач, владеющий статистикой метастазирования различных видов рака в печень, получает ценный сигнал для поиска первичной опухоли - источника метастазов.
Симптомы метастазов в печень
Симптоматика при метастатическом раке печени, в целом, аналогична симптомам других заболеваний печени - вздутие живота, тошнота, тяжесть в правом подреберье, нарушения стула, интоксикация, слабость. Более точные симптомы зависят от размера и расположения новообразования в каждом из конкретных клинических случаев.
При лечении первичных опухолей, часто метастазирующих в печень важна не столько выраженность симптомов, сколько само их наличие. Настороженность врача и пациента к возможному возникновению симптомов поражения печени позволяет своевременно выявить и начать лечение метастазов рака в печень.
Метастазы в печень - диагностика
Повышает шансы пациентов с метастазами в печень высокая доступность такого метода регулярного контроля, как ультразвуковое исследование. УЗИ печени неинвазивно, стоит недорого, проводится быстро, обеспеченность данным видом исследований высока даже в небольших городах уровня районного центра.
Однако, при появлении симптоматики, указывающей на нарушения работы печени, которые могут быть вызваны метастазами первичной опухоли (например, рака желудка), требуется привлечение более информативных диагностических методов. Чаще всего диагностика и последующее лечение метастазов в печень требует данных компьютерной томографии (КТ), реже - магнитно-резонансной томографии (МРТ) или позитронно-эмиссионной томографии (ПЭТ).
После подтверждения наличия новообразования в органе мировые стандарты онкологии предусматривают проведение биопсии метастаза в печень (забора фрагмента новообразования) для последующего морфологического изучения, в т.ч. иммуногистохимия. Тонкоигольная биопсия печени, проводимая в зоне расположения метастаза под контролем УЗИ или КТ, позволяет дать ответ о типе и особенностях клеток, из которых состоит метастаз. Это помогает выявить источник метастазов в печень - первичную опухоль, а также указывает на дополнительную возможность для комплексной терапии - иммуногистохимия может показать чувствительность опухоли и ее метастаза в печень к таргетному лечению или иммунотерапии.
Радикальное лечение метастазов в печень
Традиционно, метастазы в печень, независимо от типа первичного рака, удаляются хирургическим путем вместе с поврежденными опухолью структурами и тканями органа. Недостаток хирургии в качестве единственного метода радикального лечения метастазов в печень - значительная травматичность операции и ограничения по возможности ее проведения - ослабленный лечением первичной опухоли (хирургия, лучевая терапия, химиотерапия) организм зачастую не в состоянии будет выдержать еще одно вмешательство под общим наркозом.
Развитие технологий в медицине открыло пациентам с метастатическим раком печени иные виды щадящего радикального лечения:
- химиоэмболизация, заключающаяся в краткосрочном подведении к печени вместо крови препаратов химиотерапии в более высокой концентрации, чем при системном введении;
- радиочастотная абляция, представляющая собой воздействие на опухоль радиоволнами высокой частоты, что приводит к разрушению биологических тканей метастаза в печень вследствие их нагрева до значительных температур;
- таргетная терапия, воздействующая на клеточном уровне лишь на первичную опухоль и ее метастазы при условии ряда особенностей строения раковых клеток;
- иммунотерапия, основанная на природном механизме разрушения злокачественных клеток.
Радиохирургическое лечение метастазов в печень (КиберНож, TrueBeam STx и др.)
Наиболее совершенным методом радикального лечения метастазов в печень, является радиохирургия на КиберНоже. Также, радиохирургию позволяют реализовать некоторые модели современных линейных ускорителей, например, специализированный линейный ускоритель TrueBeam STx, который работает в отделении радиохирургии Онкологической клиники МИБС.

Высокая точность лечения метастазов в печень на линейном ускорителе TrueBeam STx: на плане лечения представлен предварительный расчет, который показывает, что высокую дозу получит только зона внутри синего контура, отвечающая по своей пространственной форме контуру метастаза в печени. Задача врачей задать контуры здоровых и пораженных тканей, а количество, формы и траекторию, по которым суперсовременный медицинский роботизированный комплекс подаст поля облучения, рассчитает мощнейший программный комплекс. Но контроль все равно за человеком – каждый план лечения утверждают медицинский физик и лучевой терапевт
Подводимая при радиохирургии на этих установках высокая (абляционная) доза ионизирующего излучения приводит к остановке биологических процессов в заданном объеме метастаза в печень. При этом повреждение здоровых тканей сведено к минимуму - разрезов не требуется, а требуемая доза губительного для тканей метастаза в печень излучения складывается из одиночных доз каждого из множественных тонких пучков. При этом каждый пучок излучения подается точно по заданной траектории, проходя через различные участки организма, не передавая дозы, способной нанести необратимое воздействие на здоровые ткани.
Преимущества метода радиохирургии:
- радикальность воздействия на заданный объем опухолевого поражения;
- безопасность для окружающих тканей;
- минимальная инвазивность, позволяющая проводить лечение амбулаторно;
- невысокая общая стоимость лечения, ввиду короткого срока пребывания в онкологической клинике и отсутствие потребности в реабилитации.
Точность радиохирургии на КиберНоже обеспечивается предварительным формированием цифровой пространственной модели формы и объема расположения метастаза в печени пациента. Визуальная модель, которая будет использована для задания параметров плана радиохирургии (зона высокой дозы, ее значение, зоны нулевой дозы для защиты критических органов и структур), строится на основе слияния нескольких источников диагностической информации, чаще всего, массивов снимков КТ и МРТ.
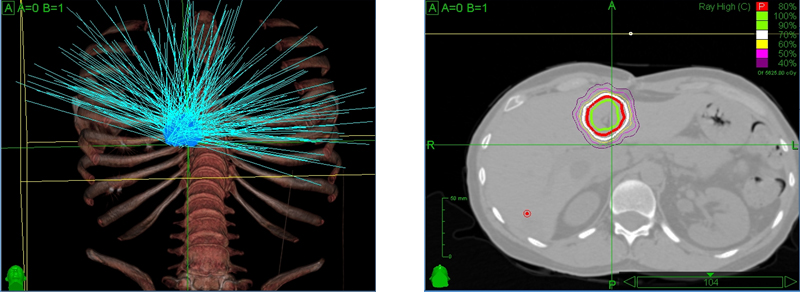
Лечение метастаза в печень, план радиохирургии на КиберНоже. Заметно, что отдельные тонкие пучки ионизирующего излучения (бирюзового цвета) пронизывают опухоль с различных сторон. При этом в зоне, в которой располагается сердце или спинной мозг, не проходит траектории ни одного луча. Зато опухолевые ткани (внутри контура салатового цвета) получают максимальную заданную дозу.
КиберНож и хирургия в лечении метастазов в печень: не конкуренты, а коллеги
Современные протоколы лечения метастатического рака печени базируются на комплексном подходе, в котором, исходя из потребностей конкретного клинического случая, сочетаются и хирургическое лечение (в том числе удаление пораженных лимфоузлов), и химиотерапия, а также лучевая терапия, радиохирургия, иммунотерапия. В таком случае врач, при условии применения щадящего метода лапароскопической хирургии, может принять решение об удалении тех метастазов, к которым имеется безопасный доступ, либо сегментов печени, пораженных значительным числом мелких метастазов.
Отделение хирургии Онкологической клиники МИБС имеет все необходимое для проведения хирургических вмешательств любой сложности, в том числе, по удалению метастазов в печень, а решение о тактике лечения принимает междисциплинарный консилиум с участием врачей-онкологов различных специальностей: клинического онколога, химиотерапевта, хирурга, лучевого терапевта, радиохирурга. Только такой подход позволяет применить любой из современных методов лечения, а не предоставляет пациенту выбор из методов, имеющихся в распоряжении конкретного онкоцентра.
КиберНож при метастазах в печень: противопоказания
Прямых противопоказаний, чтобы проводить лечение метастазов в печень КиберНожом - нет. Ограничением может являться множественное метастазирование при сравнительно небольших размерах наиболее крупных из новообразований. В таком случае противопоказаний с точки зрения медицины нет, но отсутствует финансовая целесообразность - прямого влияния на качество жизни пациента такое лечение не окажет. Также нецелесообразно проводить радиохирургию при метастазах, превышающих показатели эффективного применения системы КиберНож - как правило, семь и более сантиметров в диаметре. Но столь крупные метастазы в печень выявляются относительно редко.
Однако внимательности требует подготовка к лечению метастазов в печень на КиберНоже у пациентов с пониженной свертываемостью крови. Да, лечение КиберНожом происходит дистанционно, без контакта с организмом, но точкой “наведения” на метастаз служит метка - крошечная частица золота, которая видна на снимках системы позиционирования комплекса КиберНож. Золотые метки вводятся непосредственно в печень. Важно проводить эту процедуру одновременно с биопсией метастаза в печени (забором части новообразования для последующего морфологического анализа и контролировать показатели свертываемости крови у пациента перед началом процедуры.
Сколько стоит лечение метастазов в печень?
Оценивая стоимость лечения, особенно при сравнении программ, предлагаемых в различных онкологических центрах, следует рассматривать не только стоимость радикального лечения, но и стоимость восстановительной терапии, финансовые потери от временной потери трудоспособности, и т.д.
В случае применения КиберНожа для бесконтактного разрушения метастазов в печень более высокая стоимость лечения компенсируется отсутствием необходимости в анестезии (так как нет разрезов), нет необходимости в реабилитационных процедурах и ограничения в трудоспособности пациента (лечение выполняется амбулаторно).
При лечении за пределами своего населенного пункта, появляются затраты на проезд, перелет, проживание пациента и его сопровождающих (особенно в зарубежных клиниках), существенно увеличивает общую стоимость лечения, не гарантируя его качества.
Для жителей Санкт-Петербурга затраты на лечение в Онкологической клинике МИБС могут быть покрыты в рамках “квот”, для проживающих в других регионах России стоимость лечения может быть покрыта из бюджета регионов в случае выделения местным комитетом целевого финансирования для лечения именно в МИБС. При этом в регионах вопрос прохождения контрольного наблюдения после лечения решается проще и дешевле (без необходимости визита в Санкт-Петербург) благодаря развитой сети Диагностических центров МИБС в России и ряде соседних стран.
Насколько эффективно лечение метастазов в печень?
Современные методы терапии позволяют достичь остановки роста метастазов и даже его регресса в большинстве случаев. Однако, следует четко понимать, что лечение метастазов в печень - лишь часть задачи, которая стоит перед Вашим онкологом. Наличие метастазов говорит о распространенности процесса, и радиохирургия метастаза в печень решает только локальную проблему. А задача адекватной терапии первичной опухоли и метастазов в другие органы требует тактики комплексного лечения, определяемой при участии группы специалистов (“междисциплинарный консилиум” или “tumor-board”). Такой подход доказал свою эффективность в мировой практике и применяется в Онкологической клинике МИБС.
Вам или Вашим близким показано лечение метастазов в печень? Звоните нам сейчас!

Воробьев Николай Андреевич
Врач-онколог, врач- радиолог
Заведующий отделением протонной лучевой терапии

Разумов А.С., Будаев А.В., Вавин Г.В., Радионов И.А., Сидорова О.Д., Ставицкий Е.Е., Раева Д.А., Будаев Ф.А., Мозес В.Г.
Кемеровская областная клиническая больница имени С.В. Беляева, Кемеровский государственный медицинский университет, г. Кемерово, Россия
ОПТИМИЗАЦИЯ ТЕХНИКИ ЭКСПЛАНТАЦИИ ПЕЧЕНИ
Цель исследования – уменьшение механических и ишемических повреждений печени при эксплантации.
Материалы и методы . Выполнен эксперимент по эксплантации печени на 14 половозрелых беспородных кроликах обоего пола золетиловым наркозом. В сравнении с традиционным методом эксплантации печени в предложенной технике были следующие отличия: мобилизация желудка и петель кишечника выполнялась со смещением их влево и вниз, что обеспечивало оптимальный доступ к мезентеральным венам и задней (нижней) полой вене; катетеризация воротной вены производилась через переднюю мезентеральную вену, что снижало риск экспульсии катетера; извлечение печени производилось в составе комплекса печень-диафрагма с использованием зажимов на диафрагме, что снижало риск травматизации органа; отмывание сосудистого русла печени от крови начиналось еще до полного завершения мобилизации органа и заканчивалось практически сразу после его извлечения, что уменьшало продолжительность первичной ишемии.
Во время эксплантации проводилось отмывание сосудистого русла печени от крови 0,9 % раствором хлорида натрия с добавлением гепарина (500 ЕД/кг) под давлением 20-35 мм рт. ст. антеградно по открытому контуру через катетер в воротной вене с оттоком через катетер в нижней полой вене до появления перфузата, в котором визуально не определялась кровь. Животные были разделены на 2 серии: 1-я серия (n = 6), которым отмывание проводилось при помощи нормотермической перфузии (раствор температурой 37 ± 1°С); 2-я серия (n = 8), которым отмывание проводилось при помощи гипотермической перфузии (раствор температурой 3 ± 1°С). После проведения хронометража животные из 1-й серии ранжировались на две подгруппы: «нормотермия 1» (n = 3), у которых хронометраж составил менее 25 минут; «нормотермия 2» (n = 3), у которых хронометраж составил более 25 минут.
Через 14 часов консервации печени проводилось ее гистологическое исследование.
Результаты. Экспериментальная апробация разработанного алгоритма эксплантации печени показала уменьшение трудоемкости и травматичности операции, которое выражалось в сокращении времени ее выполнения и в уменьшении морфологических изменений трансплантатов при последующей пролонгированной статической гипотермической консервации.
Ключевые слова : трансплантация печени; эксплантация; жизнеспособность трансплантатов печени; перфузия; нормотермия; гипотермия
Razumov A.S., Budaev A.V., Vavin G.V., Radionov I.A., Sidorova O.D., Stavickij E.E., Raeva D.A., Budaev F.A., Mozes V.G.
Kemerovo Regional Clinical Hospital, Kemerovo State Medical University, Kemerovo, Russia
LIVER EXPLANATION TECHNOLOGY OPTIMIZATION
Objective – to reduce mechanical and ischemic damage to the liver during explantation.
Materials and methods. An experiment was conducted on liver explantation on 14 sexually mature outbred rabbits of both sexes with zoetil anesthesia. In comparison with the traditional method of liver explantation, the proposed technique had the following differences: the mobilization of the stomach and intestinal loops was performed with their displacement to the left and down, which provided optimal access to the mesenteric veins and the posterior (inferior) vena cava; portal vein catheterization was performed through the anterior mesenteric vein, which reduced the risk of catheter expulsion; liver extraction was performed as part of the liver-diaphragm complex using clamps on the diaphragm, which reduced the risk of organ trauma; The washing of the vascular bed of the liver from the blood began even before the complete completion of the mobilization of the organ and ended almost immediately after its extraction, which reduced the duration of primary ischemia.
During explantation, the vascular bed of the liver was washed from the blood with a 0.9 % sodium chloride solution with the addition of heparin (500 ME/kg) under a pressure of 20-35 mmHg antegrade along an open circuit through a catheter in the portal vein with an outflow through the catheter in the inferior vena cava until a perfusate appears in which blood was not visually detected. The animals were divided into 2 series: 1st series (n = 6), which were washed using normothermic perfusion (solution at 37 ± 1°C); 2nd series (n = 8) with which washing was carried out using hypothermic perfusion (solution with a temperature of 3 ± 1°C). After 14 hours of liver preservation, its histological examination was performed.
Results. Experimental testing of the developed liver explantation algorithm showed a decrease in the laboriousness and invasiveness of the operation, which was expressed in a reduction in the time of its implementation and in a decrease in morphological changes in the transplants during subsequent prolonged static hypothermic preservation.
Key words : liver transplantation; explantation; viability of liver transplantates; perfusion; normothermia; hypothermia
Корреспонденцию адресовать:
Сведения об авторах:
РАДИОНОВ Игорь Александрович
доктор мед. наук, доцент, профессор кафедры госпитальной хирургии, ФГБОУ ВО КемГМУ Минздрава России, г. Кемерово, Россия
СИДОРОВА Ольга Дмитриевна
доктор мед.наук, профессор, зав. кафедрой гистологии, ФГБОУ ВО КемГМУ Минздрава России, г. Кемерово, Россия
РАЕВА Дарья Александровна
с тудентка 5 курса лечебного факультета, ФГБОУ ВО КемГМУ Минздрава России, г. Кемерово, Россия
БУДАЕВ Ф.А., аспирант, ФГБОУ ВО КемГМУ Минздрава России, г. Кемерово, Россия
Information about authors:
BUDAEV Alexey Vladimirovich
doctor of medical sciences, docent, professor of the department of pathological physiology, Kemerovo State Medical University, Kemerovo, Russia
RADIONOV Igor Alexandrovich
doctor of medical sciences, docent, professor of the department of hospital surgery, Kemerovo State Medical University, Kemerovo, Russia
SIDOROVA Olga Dmitrievna
doctor of medical sciences, professor, head of the department of histology, Kemerovo State Medical University, Kemerovo, Russia
STAVITSKY E.E.
5th year student of the faculty of medicine, Kemerovo State Medical University, Kemerovo, Russia
RAEVA Darya Alexandrovna
5 year student of the faculty of medicine, Kemerovo State Medical University, Kemerovo, Russia
BUDAEV F.A.
graduate student, Kemerovo State Medical University, Kemerovo, Russia
Одной из актуальных проблем современной трансплантологии является своевременное обеспечение всех нуждающихся пациентов жизнеспособными и функционально активными трансплантатами [1]. Ежегодно до 25 % очередников умирают, так и не дождавшись трансплантата [2]. Успех трансплантации печени напрямую зависит от качества печеночного трансплантата, поэтому дефицит донорских органов обусловлен не столько отсутствием самих органов, сколько сложностью сохранения жизнеспособности печени на всех этапах трансплантации, в том числе при изъятии (эксплантации) ее у донора [3].
Основными повреждающими факторами при эксплантации печени являются механические, ишемические и перфузионные, которые во многом обусловлены анатомическими особенностями расположения и кровоснабжения печени. Дополнительными факторами, влияющими на качество донорской печени при ее эксплантации, считаются не всегда адекватная последовательность выделения органа, перевязки и катетеризации сосудов; неправильный температурный и скоростной режимы отмывания печени от крови. В свою очередь, повреждения печени при эксплантации могут потенцировать развитие новых ишемических и реперфузионных повреждений при последующей консервации и имплантации трансплантата [4]. Поэтому во всем мире идет активный поиск новых техник и методик экплантации печени, позволяющих минимизировать указанные риски.
Цель исследования – уменьшение механических и ишемических повреждений печени при эксплантации.
МАТЕРИАЛ И МЕТОДЫ
Эксперименты выполнены на 14 половозрелых беспородных кроликах обоего пола массой 2,9 ± 0,38 кг под золетиловым наркозом (45 мг/кг внебрюшинно) в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации о гуманном обращении с животными (1996). Протокол исследования одобрен Комитетом по этике и доказательности медицинских научных исследований ФГБОУ ВО КемГМУ Минздрава России.
Отмывание сосудистого русла печени от крови во время эксплантации проводилось 0,9 % раствором хлорида натрия с добавлением гепарина (500 ЕД/кг) под давлением 20-35 мм рт. ст. антеградно по открытому контуру через катетер в воротной вене с оттоком через катетер в нижней полой вене до появления перфузата, в котором визуально не определялась кровь.
Животные были разделены на 2 серии:
1-я серия (n = 6), в которой отмывание сосудистого русла печени от крови проводилось раствором с температурой 37 ± 1 о С – нормотермическая перфузия;
2-я серия (n = 8), в которой отмывание сосудистого русла печени от крови проводилось раствором с температурой 3 ± 1 о С – гипотермическая перфузия.
Всем животным выполнялись основные этапы операции:
1. Лапаротомия. Оперативный доступ «мерседес» [5] (рис. 1).
2. Выделение нижней полой и воротных вен.
3. Катетеризация нижней полой и воротной вен. Перфузия печени.
4. Эксплантация печени.
Рисунок 1. Оперативный доступ
Picture 1. Online access
После вскрытия брюшной полости (рис. 2) петли кишечника и желудок аккуратно отводили влево и вниз (рис. 3), что позволяло освободить подпеченочное пространство и визуализировать нижнюю полую и воротную вены, которые выделяли и подводили под них лигатуры (рис. 4).
Рисунок 2. Вскрытие брюшной полости
Picture 2. Dissection of the abdominal cavity
Рисунок 3. Иммобилизация петель кишечника и желудка
Picture 3. Immobilization of intestinal and stomach loops
Рисунок 4. Визуализация и выделение сосудов
Picture 4. Vascular imaging and isolation
Воротную вену катетеризировали через переднюю (верхнюю) мезентериальную вену, что позволяло надежно фиксировать катетер, избежать манипуляций в области ворот печени и, тем самым, ограничить ее механические повреждения и риск кровотечений. После катетеризации воротной вены незамедлительно катетеризировали заднюю (нижнюю) полую вену (рис. 5) и начинали отмывание сосудистого русла печени от крови.
Рисунок 5. Катетеризация воротной и задней (нижней) полой вен
Picture 5. Catheterization of the portal and posterior (inferior) vena cava
Сразу же после начала перфузии вскрывали грудную клетку и перевязывали грудной отдел задней полой вены и аорту. Избегая механических воздействий на печень, завершали ее мобилизацию, производили отсечение грудинной и реберной частей диафрагмы. На оставшуюся часть диафрагмы накладывали зажимы, с помощью которых смещали ее каудально и обнажали ножки диафрагмы; после их пересечения комплекс печень-диафрагма извлекался (рис. 6).
Рисунок 6. Извлечение комплекса печень-диафрагма
Picture 6. Extraction of the liver-diaphragm complex
После извлечения завершали отмывание печени от крови и через катетер в воротной вене заполняли сосудистое русло печени охлажденным раствором кустодиола. Затем погружали печень в раствор кустодиола и хранили при температуре 3 ± 1 о С до последующих исследований [6].
При оценке хронометража продолжительности первичной ишемии печени при выполнении предложенной техники эксплантации печени первой фиксажной точкой являлось начало перевязки и катетеризации воротной вены, второй фиксажной точкой являлось заполнение сосудистого русла печени кустодиолом. Замеры времени производились независимым наблюдателем собирательным способом с помощью секундомера - наблюдатель по фиксажным точкам засекал время и заносил показания секундомера в статистическую карту. Полученные значения продолжительности операции записывались в хронометражный вариационный ряд.
После проведения хронометража животные из 1-й серии ранжировались на две подгруппы: «нормотермия 1» (n = 3), у которых хронометраж составил менее 25 минут; «нормотермия 2» (n = 3), у которых хронометраж составил более 25 минут.
Через 14 часов статической гипотермической консервации из краевой и центральный части правой латеральной доли печени производился забор материала для гистологического исследования (рис. 7). Срезы окрашивались гематоксилин-эозином, исследование материала проводилось под 1000-кратным увеличением.
Рисунок 7. Локализация участков забора материала для гистологического исследования
Picture 7. Localization of material sampling sites for histological examination
Примечание (Note) : а) диафрагмальная поверхность печени (diaphragmatic surface of the liver); б) висцеральная поверхность печени (the visceral surface of the liver); ПВ – полая вена (vena cava); ЖП – желчный пузырь (gall bladder); ПКД – правая квадратная доля (the right square fraction); ПЦД – правая центральная доля (the right central lobe); ПЛД – правая латеральная доля (the right lateral lobe); ЛЦД – левая центральная доля (the left central lobe); ЛЛД – левая латеральная доля (the left lateral lobe); ПД – папиллярная доля (papillary lobe); КД – квадратная доля (square fraction); ХД – хвостатая доля (caudate lobe). Забор материала (sampling of material): 1. краевой участок ПЛД (the regional section of the PLD) (п); 2. центральный участок ПЛД (the central section of the PLD) ( ц ).
Описание количественных признаков, подчиняющихся закону нормального распределения, описано средней величиной и среднеквадратическим отклонением (М ± δ).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Средняя продолжительность первичной ишемии печени (время от перевязки и катетеризации воротной вены до заполнения сосудистого русла печени кустодиолом) при выполнении предложенной техники эксплантации составила 22,33 ± 4,67 мин.
Результаты проведенного эксперимента показали, что, по сравнению с традиционными методами, предложенная техника сопровождалась меньшей трудоемкостью и травматичностью операции и механическим воздействием на печень 8. Это достигалось двумя факторами.
Во-первых, за счет мобилизации желудка и петель кишечника со смещением их влево и вниз обеспечивался оптимальный доступ к мезентериальным венам и задней (нижней) полой вене.
Во-вторых, катетеризация воротной вены из-за ее анатомических особенностей (малая протяженность, прочная связь с жировой клетчаткой, содержащей множество мелких сосудов) сопряжена с техническими трудностями ее выделения, высоким риском травматизации сосудистой стенки и ворот печени. Малая протяженность воротной вены не позволяет надежно фиксировать катетер, который может легко выйти из вены, особенно при извлечении печени. Предлагаемая катетеризация воротной вены через переднюю мезентеральную вену позволяет минимизировать эти риски.
В-третьих, извлечение печени в составе комплекса печень-диафрагма с использованием зажимов на диафрагме позволяет практически полностью исключить механические воздействия хирурга на печень.
В-четвертых, отмывание сосудистого русла печени от крови начинается еще до полного завершения мобилизации печени и заканчивается практически сразу после ее извлечения, что позволяет существенно уменьшить продолжительность первичной ишемии органа.
Результаты морфологического исследования печени (табл.) показали, что использование для отмывания сосудистого русла печени от крови охлажденного раствора (3 ± 1°С) позволяет уменьшить морфологические изменения в трансплантате печени при пролонгированной статической гипотермической консервации в кустадиоле по сравнению с нормотермической перфузией при эксплантации.
Таблица. Морфологическая характеристика микропрепаратов печени
Table. Morphological characteristics of liver micropreparations
Читайте также:


