Гелий и водород находятся в теплоизолированном цилиндре под поршнем объем занимаемый смесью газов
Обновлено: 06.05.2024
Гелий и водород находятся в теплоизолированном цилиндре под поршнем объем занимаемый смесью газов
Теплоизолированный цилиндр разделён подвижным теплопроводящим поршнем на две части. В одной части цилиндра находится гелий, а в другой — аргон. В начальный момент температура гелия равна 300 К, а аргона — 900 К, объёмы, занимаемые газами, одинаковы, а поршень находится в равновесии.
Во сколько раз изменится объём, занимаемый гелием, после установления теплового равновесия, если поршень перемещается без трения? Теплоёмкостью цилиндра и поршня пренебречь.
Гелий и аргон можно описывать моделью идеального одноатомного газа, для которого применимо уравнение Клапейрона — Менделеева
Поршень в цилиндре вначале находится в состоянии механического равновесия, значит, давления газов в начальный момент совпадают. То же самое можно сказать и про конечный момент времени. В начальный момент объёмы газов одинаковы и равны и уравнение Клапейрона — Менделеева приводит к связи между начальными температурами гелия и аргона и и числом молей этих газов и :
После установления теплового равновесия температура газов равна а объёмы гелия и аргона изменились и стали равны и соответственно. Уравнения Клапейрона — Менделеева в этот момент приводят к соотношению Поскольку суммарный объём цилиндра остался неизменным: получаем, что Учитывая, что получим
I) записаны положения теории и физические законы, закономерности, применение которых необходимо для решения задачи выбранным способом (в данном случае – уравнение Клапейрона–Менделеева, условие равновесия поршня);
II) описаны все вводимые в решении буквенные обозначения физических величин (за исключением, возможно, обозначений констант, указанных в варианте КИМ, и обозначений, используемых в условии задачи);
III) проведены необходимые математические преобразования (допускается вербальное указание на их проведение) и расчёты, приводящие к правильному числовому ответу (допускается решение «по частям» с промежуточными вычислениями);
Записи, соответствующие одному или обоим пунктам: II и III, – представлены не в полном объёме или отсутствуют.
При ПОЛНОМ правильном решении лишние записи, не входящие в решение (возможно, неверные), не отделены от решения (не зачёркнуты, не заключены в скобки, рамку и т. п.).
При ПОЛНОМ решении в необходимых математических преобразованиях или вычислениях допущены ошибки, и (или) преобразования/вычисления не доведены до конца.
Представлены только положения и формулы, выражающие физические законы, применение которых необходимо для решения задачи, без каких-либо преобразований с их использованием, направленных на решение задачи, и ответа.
В решении отсутствует ОДНА из исходных формул, необходимая для решения задачи (или утверждение, лежащее в основе решения), но присутствуют логически верные преобразования с имеющимися формулами, направленные на решение задачи.
Домашнее задание на каникулы
3. Равные массы гелия и водорода находятся в теплоизолированном цилиндре под поршнем. Объем цилиндра V0 = 1 л, давление в нем P0 = 9 атм. При адиабатическом расширении смесь газов совершает работу A = 650 Дж. Найти относительное изменение температуры смеси.
4. Гелий и водород находятся в теплоизолированном цилиндре под поршнем. Объем, занимаемый смесью газов V0 = 1 л, давление P0 = 37 атм. При адиабатическом расширении смеси газов относительное уменьшение температуры составило 75%. Найти работу, совершаемую при этом смесью газов, если масса водорода в 1,5 раза больше массы гелия.
7. Чтобы поднять температуру 1 кг неизвестного газа на один градус при постоянном давлении, требуется 909 Дж тепла, а при постоянном объеме — 650 Дж. Что это за газ?
8. Разреженный газ нагревают в сосуде постоянного объема, при этом его удельная теплоемкость оказывается равной 740 Дж/(кг • К). Что это за газ?
14. Температура гелия уменьшается в 2 раза в процессе P 2 V = const (P — давление, V — объем газа). Найти: 1) начальный объем газа V1, 2) изменение его внутренней энергии в процессе охлаждения. Начальное давление газа P1 = 10 5 Па, а минимальный объем, который он занимал в процессе охлаждения, составил Vmin = 1 л.
15. Температура гелия уменьшается в 3 раза в процессе PV 2 = const (P — давление газа, V — его объем) При этом его внутренняя энергия изменилась на величину, равную 50 Дж. Найти: 1) максимальное давление газа Pmax, 2) величину объема газа Vк в конечном состоянии. Минимальное давление газа в этом процессе составило Pmin = 10 5 Па.
16. Температура гелия увеличилась в 3 раза в процессе P 2 V = const (P — давление, V — объем газа), а его внутренняя энергия изменилась на 100 Дж. Найти: 1) начальный объем V1 газа; 2) начальное давление P1 газа. Максимальный объем, который занимал газ в процессе нагрева, равнялся Vmax = 3 л.
Гелий и водород находятся в теплоизолированном цилиндре под поршнем объем занимаемый смесью газов
2011 год 109 вариант СЗ
В сосуде лежит кусок льда. Температура льда t1 = 0°С. Если сообщить ему количество теплоты Q = 50 кДж, то 3/4 льда растает. Какое количество теплоты q надо после этого сообщить содержимому сосуда дополнительно, чтобы весь лёд растаял и образовавшаяся вода нагрелась до температуры t2 = 20°С? Тепловыми потерями на нагрев сосуда пренебречь. (Решение)
2011 год. 01-2 вариант. С3
В бутылке объемом V = 1 л находится гелий при нормальном атмосферном давлении. Горлышко бутылки площадью S = 2 см 2 заткнуто короткой пробкой, имеющей массу m = 20 г. Если бутылка лежит горизонтально, то для того, чтобы медленно вытащить из ее горлышка пробку, нужно приложить к пробке горизонтально направленную силу F = 1 Н. Бутылку поставили на стол вертикально горлышком вверх. Какое количество теплоты нужно сообщить гелию в бутылке для того, чтобы он выдавил пробку из горлышка? (Решение)
2011 год. 01-1 вариант. С3
Один моль идеального одноатомного газа переводят из состояния 1 с температурой Т1 = 300 К в состояние 2 таким образом, что в течение всего процесса давление газа возрастает прямо пропорционально его объему. В ходе этого процесса газ получает количество теплоты Q = 14958 Дж. Во сколько раз n уменьшается в результате этого процесса плотность газа? (Решение)
2010 год. 11 вариант. С1
В кабинете физики проводились опыты с разреженным газом постоянной массы. По невнимательности ученик, отметив на графике начальное и конечное состояния газа (см. рисунок), не указал, какие две величины из трёх (давление р, объём V, температура Т) отложены по осям. В журнале осталась запись, согласно которой названные величины изменялись следующим образом: p1 < р2, V1 > V2, Τ1 < Ί2. Пользуясь этими данными, определите, какие величины были отложены на горизонтальной и вертикальной осях. Ответ поясните, указав, какие физические закономерности вы использовали. (Решение)
2010 год 304 вариант СЗ
Некоторое количество одноатомного идеального газа расширяется из одного и того же начального состояния (p1, V1) до одного и того же конечного объёма V2 первый раз по изобаре, а второй - по адиабате (см. рисунок). Отношение количества теплоты Q12, полученного газом на изобаре от нагревателя, к модулю изменения внутренней энергии газа |U3 — U1| на адиабате k = Q12/|U3 — U1| = 6 . Чему равно отношение х работы газа на изобаре А12 к работе газа на адиабате А13? (Решение)
2010 год. 135 вариант. С5
В цилиндр закачивается воздух со скоростью 0,002 кг/с. В верхнем торце цилиндра есть отверстие площадью 5·10 -4 м 2 , закрытое предохранительным клапаном. Клапан удерживается в закрытом состоянии невесомым стержнем длиной 0,5 м, который может свободно поворачиваться вокруг оси в точке А (см. рисунок). Расстояние АВ равно 0,1 м. К свободному концу стержня подвешен груз массой 2 кг. Клапан открывается через 580 с работы насоса, если в начальный момент времени давление воздуха в цилиндре было равно атмосферному. Температура воздуха в цилиндре и снаружи не меняется и равна 300 К. Определите объём цилиндра. (Решение)
2009 год. 133 вариант. С1
В цилиндрическом сосуде под поршнем длительное время находятся вода и ее пар. Поршень начинают вдвигать в сосуд. При этом температура воды и пара остается неизменной. Как будет меняться при этом масса жидкости в сосуде? Ответ поясните. (Решение)
2009 год. 133 вариант. С3
Один моль одноатомного идеального газа переходит из состояния 1 в состояние 3 в соответствии с графиком зависимости его объёма V от температуры T (T0 = 100 К). На участке 2 − 3 к газу подводят 2,5 кДж теплоты. Найдите отношение работы газа А123 ко всему количеству подведенной к газу теплоты Q123. (Решение)
2009 год. 304 вариант. С3
Постоянная масса одноатомного идеального газа совершает циклический процесс, показанный на рисунке. За цикл от нагревателя газ получает количество теплоты QH = 8 кДж. Какую работу совершают внешние силы при переходе газа из состояния 2 в состояние 3? (Решение)

2008 год. 131 вариант. С2
Разогретый сосуд прикрыли поршнем, который с помощью вертикальной нерастяжимой нити соединили с потолком. На сколько процентов от начальной понизится температура воздуха в сосуде к моменту, когда сосуд оторвется от поверхности, на которой он расположен? Масса сосуда 5 кг. Поршень может скользить по стенкам сосуда без трения. Площадь дна сосуда 125 см 2 . Атмосферное давление 10 5 Па. Тепловым расширением сосуда и поршня пренебречь. (Решение)
2008 год. 5941 вариант. С2
В калориметре находился m1 = 1 кг льда при температуре t1 = -5°С. После добавления в калориметр m2 = 25 г воды в нем установилось тепловое равновесие при температуре t = 0°С. Какова температура t2 добавленной в калориметр воды, если в калориметре оказался в итоге только лёд? Теплоёмкостью калориметра пренебречь. (Решение)
2008 год. 05205939 вариант. С2
В горизонтально расположенной трубке постоянного сечения, запаянной с одного конца, помещен столбик ртути длиной 15 см, который отделяет воздух в трубке от атмосферы. Трубку расположили вертикально запаянным концом вниз. На сколько градусов следует нагреть воздух в трубке, чтобы объём, занимаемый воздухом, стал прежним? Температура воздуха в лаборатории 300 К, а атмосферное давление составляет 750 мм рт.ст. (Решение)
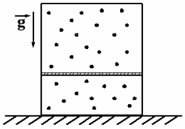
2008 год. 2 вариант. С2
Вертикально расположенный замкнутый цилиндрический сосуд высотой 50 см разделен подвижным поршнем весом 110 Н на две части, в каждой из которых содержится одинаковое количество водорода при температуре 361 К. Какая масса газа находится в каждой части цилиндра, если поршень находится на высоте 20 см от дна сосуда? Толщиной поршня пренебречь. (Решение)
2007 год. 19 вариант. С2
В сосуде находится одноатомный идеальный газ, масса которого 12 г, а молярная масса 0,004 кг/моль. Вначале давление в сосуде было равно 4•10 5 Па при температуре 400 К. После охлаждения газа давление понизилось до 2•10 5 Па. Какое количество теплоты отдал газ? (Решение)
2006 год. 61 вариант. С2
В водонепроницаемый мешок, лежащий на дне моря на глубине 73,1 м, закачивается сверху воздух. Вода вытесняется из мешка через нижнее отверстие, и когда объём воздуха в мешке достигает 28,0 м 3 - мешок всплывает вместе с прикреплённым к нему грузом. Масса оболочки мешка 2710 кг. Определите массу груза. Температура воды равна 7°С, атмосферное давление на уровне моря равно 10 5 Па. Объёмом груза и стенок мешка пренебречь. (Решение)
2006 год. 86 вариант. С2
Теплоизолированный сосуд объемом V = 2 м 3 разделен теплоизолирующей перегородкой на две равные части. В одной части сосуда находится 2 моль гелия, а в другой - такое же количество молей аргона. Начальная температура гелия равна 300 К, а температура аргона 600 К. Определите давление смеси после удаления перегородки. Теплоемкостью сосуда пренебречь. (Решение)
2006 год. 33 вариант. С2
Воздушный шар объемом 2500 м 3 с массой оболочки 400 кг имеет внизу отверстие, через которое воздух в шаре нагревается горелкой. Температура окружающего воздуха 7°С, его плотность 1,2 кг/м 3 . При какой минимальной разности температур воздуха внутри шара и снаружи шар взлетит вместе с грузом (корзиной и воздухоплавателем) массой 200 кг? Оболочку шара считать нерастяжимой. (Решение)
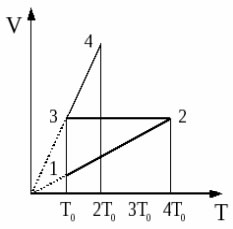
2006 год. 222 вариант. С2
С одним молем идеального одноатомного газа совершают процесс 1-2-3-4, показанный на рисунке в координатах V-Т. Во сколько раз количество теплоты, полученное газом в процессе 1-2-3-4, больше работы газа в этом процессе? (Решение)
2005 год. 58 вариант. С2
Идеальный одноатомный газ в количестве 1 моль сначала изотермически расширился при температуре T1 = 300 К. Затем газ изобарно нагрели, повысив температуру в 3 раза. Какое количество теплоты получил газ на участке 2-3? (Решение)
2004 год. 92 вариант. С2
10 моль одноатомного идеального газа сначала охладили, уменьшив давление в 3 раза, а затем нагрели до первоначальной температуры 300 К (см. рисунок). Какое количество теплоты получил газ на участке 2-3? (Решение)
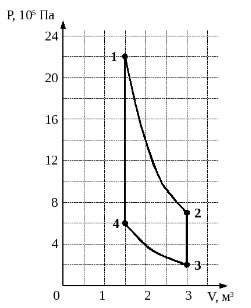
2004 год. 77 вариант. С5
Идеальный одноатомный газ используется в качестве рабочего тела в тепловом двигателе. В ходе работы двигателя состояние газа изменяется в соответствии с циклом, состоящим из двух адиабат и двух изохор (см. рисунок). Вычислите КПД такого двигателя. (Решение)
2004 год. 49 вариант. С5
При электролизе воды образуется кислород О2 и водород Н2. Газы отводят в сосуд объёмом 100 л, поддерживая в нём температуру 300 К. Чему равна масса воды, которая разложилась в результате электролиза, чтобы суммарное давление в сосуде достигло 0,1 атм? Считать, что ничего не взрывается. (Решение)
2004 год. 35 вариант. С5
Смесь одинаковых масс гелия, водорода и азота помещена в сосуд и нагрета до температуры 350 К. Плотность смеси оказалась равной 50 г/м 3 . Чему равно давление в сосуде? (Решение)
Хочу учиться на ВМК!
Задачи, предлагавшиеся на вступительных экзаменах на факультет вычислительной математики и кибернетики МГУ им. М.В.Ломоносова в 2005 г.
I. МЕХАНИКА (окончание)
9 Два одинаковых шарика массой m каждый, связанные пружиной жёсткостью k и длиной l, лежат неподвижно на гладком горизонтальном столе. Третий такой же шарик движется со скоростью 0 по линии, соединяющей центры шариков, связанных пружиной, и упруго соударяется с одним из них. Определите максимальное и минимальное расстояния между шариками, связанными пружиной, при их дальнейшем движении. Принять, что Массой пружины, временем соударения и трением пренебречь.
Из законов сохранения импульса и энергии, записанных для упругого соударения одинаковых по массе шариков, следует, что они при центральном ударе обмениваются скоростями. Поэтому после соударения двигавшийся шарик остановится, а покоившийся приобретёт скорость 0. При последующем движении шариков, связанных пружиной, будут сохраняться импульс и энергия этой системы. Учитывая, что в моменты времени, когда расстояния между шариками максимальны или минимальны, их относительная скорость обращается в нуль, для этих моментов времени имеем:
где – скорость шариков, x – удлинение пружины. Из этих соотношений находим
10 Груз массой M подвешен на пружине. Удерживая груз в положении равновесия, на него кладут брусок массой m, а затем отпускают. С какой максимальной силой брусок будет действовать на груз в процессе движения? Ускорение свободного падения g. Сопротивлением воздуха пренебречь.
Из условия равновесия неподвижно висящего груза kx0 = Mg следует, что удлинение пружины при этом равно где k – жёсткость пружины. Совместим начало отсчёта потенциальной энергии с концом недеформированной пружины. Учитывая, что при максимальном растяжении пружины (x = xmax) скорость груза с бруском обращается в нуль, запишем закон сохранения энергии:
Подставляя сюда x0, находим
Запишем далее уравнения движения для груза с бруском и отдельно для бруска:
Отсюда сила, с которой груз действует на брусок, равна
Максимальное значение эта сила принимает при x = xmax. Объединяя записанные выражения, получаем окончательно
II. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
1 Плотность смеси азота и кислорода при температуре t = 17 °С и давлении p0 = 10 5 Па равна = 1,2 кг/м 3 . Найдите концентрации n1 и n2 молекул азота и кислорода в смеси. Молярная масса азота M1 = 28 г/моль, кислорода M2 = 32 г/моль. Постоянная Больцмана k = 1,38 · 10 –23 Дж/К, универсальная газовая постоянная R = 8,31 Дж/(моль·К).
Плотность и давление идеального газа выражаются следующим образом: p = nkT, где n – концентрация молекул, M – молярная масса газа, k – постоянная Больцмана, NA – число Авогадро, T – абсолютная температура. Используя эти выражения, для смеси газов получаем систему уравнений:
Отсюда, учитывая, что kNA = R, получаем ответ:
2 Тонкая сферическая оболочка воздушного шара изготовлена из однородного материала, масса единицы площади которого = 1 кг/м 2 . Шар наполнен гелием при атмосферном давлении p0 = 10 5 Па. Какой минимальный радиус rmin должен иметь шар, чтобы он начал подниматься? Температуры гелия и окружающего воздуха одинаковы и равны t0 = 0 °С. Молярные массы гелия и воздуха соответственно MHe = 4 г/моль и Mв = 29 г/моль. Универсальная газовая постоянная R = 8,31 Дж/(моль · К).
Шар будет подниматься, если действующая на него выталкивающая сила превысит силу тяжести. По закону Архимеда, выталкивающая сила равна mвg, где mв – масса воздуха в объёме, занимаемом шаром. Обозначив через mHe массу гелия, содержащегося в шаре, а через M – массу оболочки шара, запишем условие, при котором шар начнёт подниматься:
Массы гелия и воздуха, содержащихся в объёме V, можно найти из уравнений состояния этих газов:
где T0 = t0 + 273 °C, Учитывая, что масса оболочки шара равна , перепишем условие подъёма шара в виде
При этом знак равенства достигается при минимальном радиусе шара.
3 Внутри вертикально расположенного цилиндра, воздух из которого откачан, находится тонкий массивный поршень. Под поршень ввели смесь водорода и гелия, в результате чего поршень поднялся до середины цилиндра. Поскольку материал, из которого изготовлен поршень, оказался проницаемым для гелия, поршень начал медленно опускаться. Спустя достаточно большое время поршень занял окончательное положение равновесия на высоте, составляющей 1/3 высоты цилиндра. Найдите отношение k масс водорода и гелия в смеси в первоначальный момент. Молярная масса водорода M1 = 2 г/моль, молярная масса гелия M2 =
= 4 г/моль. Температуру считать постоянной.
Пусть m1 и m2 – соответственно массы водорода и гелия в смеси, M0 – масса поршня, V – объём цилиндра, S – площадь сечения поршня, T – температура. Из условия равновесия поршня и уравнения начального состояния смеси следует равенство
В конечном состоянии, когда диффузия гелия закончится, концентрация гелия в обеих частях цилиндра станет одинаковой. Следовательно, станут равными парциальные давления гелия снизу и сверху от поршня. Поэтому давление поршня будет уравновешиваться только давлением водорода:
Сопоставляя записанные выражения, получаем, что Массы водорода и гелия в смеси были одинаковыми.
4 В тепловом двигателе, рабочим телом которого является идеальный одноатомный газ, совершается циклический процесс, изображённый на рисунке. Максимальный объём газа в этом процессе в n = 3 раза больше минимального объёма. Найдите КПД двигателя .
Работа газа в циклическом процессе численно равна площади фигуры, ограниченной графиком процесса на p, V-диаграмме:
где p1 и V1 – давление и объём газа в точке 1. Количество теплоты, полученной газом в данном процессе,
Поскольку />RT1 = p1V1 и />RT2 = n 2 p1V1, то Q1–2 = 2p1V1(n 2 – 1). КПД цикла
5 В тепловом двигателе, рабочим телом которого является идеальный одноатомный газ, совершается циклический процесс, изображённый на рисунке, где участок 2–3 – адиабатическое расширение, а участок 4–1 – адиабатическое сжатие. Найдите КПД двигателя , если известно, что температура газа при адиабатическом расширении уменьшается в n раз, а при адиабатическом сжатии увеличивается в n раз, где n = 1,5.
Работа газа за цикл равна алгебраической сумме количеств теплоты, которыми газ обменивается с окружающими телами:
Количество теплоты, полученной газом, равно
Следовательно, КПД цикла
По условию задачи, T2 = nT3; T1 = nT4.
6 В тепловом двигателе, рабочим телом которого является один моль идеального одноатомного газа, совершается циклический процесс, изображённый на рисунке, где участок 2–3 – изотермическое расширение. Найдите работу газа на участке 2 – 3, если КПД двигателя = 20%, а разность между максимальной и минимальной температурами газа T = 100 К.
Работа газа за цикл равна (см. решение задачи 5)
Количество теплоты, полученное газом, равно
Следовательно, КПД рассматриваемого цикла равен
По условию задачи, T2 = T3 = Tmax. Поэтому
Отсюда В изотермическом процессе количество теплоты, полученное от термостата, равно работе газа Q2–3 = A2–3.
Задание 30. Молекулярная физика. Расчетная задача
На решение примерно отводится 15-20 минут.
Для выполнения задания 30 по физике необходимо знать:
- Парциальное давление
- Относительная влажность.
- Закон Паскаля
Задачи для тренировки
Гелий в количестве ν = 3 моль изобарно сжимают, совершая работу A1 = 2,4 кДж. При этом температура гелия уменьшается в 4 раза: T2 = T1/4 Затем газ адиабатически расширяется, при этом его температура изменяется до значения T3 = T1/8. Найдите работу газа А2 при адиабатном расширении. Количество вещества в процессах остаётся неизменным.
Два газа находятся внутри теплоизолированного цилиндра и разделены подвижным поршнем. Слева от поршня находится кислород при температуре 500 К, а справа азот с температурой 400 К. Кислород занимает объем вдвое больший, чем азот, поршень находится в равновесии. Во сколько раз увеличится объем азота, если произойдет тепловое равновесие, а поршень будет перемещаться без трения? Теплоёмкость цилиндра и поршня не учитывать.
В ведре находился лед при температуре -10 градусов. После добавления в ведро воды массой 10 кг при температуре 25 градусов установилось тепловое равновесие и температура воды стала равна 0 градусов. Чему равнялась масса льда до добавления воды?
В двух теплоизолированных котлах находятся два различных газа. Котлы соединены теплоизолированной трубкой с краном. В первом котле размещены 1 моль водорода при температуре 885 К. Вот втором- 4 моль кислорода при температуре 1100 К. Какая температура установилась в котлах после того, как кран открыли и газы пришли в равновесное состояние?
Идеальный одноатомный газ перешел из состояния 1 в состояние 3 в соответствии с графиком, представленном ниже. Найдите количество теплоты, которое было получено или отдано газом при этом переходе.
32. Работа газа. Первое начало термодинамики: задачи с ответами без решений
(Все задачи по молекулярно-кинетической теории и ответы к ним находятся в zip-архиве (290 кб), который можно скачать и открыть на своем компьютере. Попробуйте решить задачи самостоятельно и только потом сравнивать свои ответы с нашими. Желаем успехов!)
32.1. Какова внутренняя энергия одноатомного газа, занимающего при температуре T объем V, если концентрация молекул n? [ U = (3/2)nkTV ]
32.2. В цилиндре с площадью основания S = 100 см 2 находится газ при температуре t = 27 °С. На высоте h = 30 см от дна цилиндра расположен поршень массой m = 60 кг. Какую работу совершит газ, если его температуру медленно повысить на Δt = 50 °С? Атмосферное давление po = 10 5 Па. [ A ≅ 79.4 Дж ]
32.3. Газообразный водород массой m = 0,1 кг совершает круговой процесс 1 – 2 – 3 – 1 (рис.). Найдите работу газа на участке 1 – 2, если Т1 = 300 K, a V2 = 3V1. [ A = 2.5×10 5 Дж ]
32.4. Идеальный газ массой m = 20 г и молярной массой M = 28 г/моль совершает замкнутый процесс (рис.). Температура в точках 1 и 2 равна: T1 = 300 К; Т2 = 496 К. Найти работу газа за цикл. [ A = 1162 Дж ]
32.5. Давление ν молей идеального газа связано с температурой по закону: Т = αp 2 (α = const). Найти работу газа при увеличении объема от значения V1 до значения V2. Выделяется или поглощается при этом тепло? [смотрите ответ в общем файле темы]
32.6. В цилиндре под невесомым поршнем находится газ. Поршень связан с дном цилиндра пружиной. Газ расширяется из состояния с параметрами p1, V1 в состояние p2, V2. Определить работу газа. [смотрите ответ в общем файле темы]
32.7. ν молей идеального газа помещены в герметическую упругую оболочку. Упругость оболочки такова, что квадрат объема пропорционален температуре. На сколько изменится энергия оболочки, если газ нагреть от температуры T1 до температуры T2? Какова теплоемкость системы? Теплоемкостью оболочки и внешним давлением пренебречь. [смотрите ответ в общем файле темы]
32.8. При изотермическом процессе газ совершил работу 1000 Дж. На сколько увеличится внутренняя энергия этого газа, если ему сообщить количество теплоты вдвое больше, чем в первом случае, а процесс проводить изохорически? [2000 Дж]
32.9. Найти количество теплоты, сообщенное газу в процессе 1 – 2 (рис.). [ Q = 3pV/4 ]
32.10. Один моль идеального газа совершает процесс 1 – 2 – 3 (рис.). Известны: давление p1, p2 и объем V1, V2. Найти поглощенное газом в этом процессе количество теплоты. [смотрите ответ в общем файле темы]
32.11. Один моль идеального газа нагревают сначала изотермически. При этом он совершает работу 10 Дж. Затем его нагревают изобарически, сообщая ему то же количество теплоты. Какую работу совершает газ во втором случае? [4 Дж]
32.12. Водород массой m = 1 кг при начальной температуре T1 = 300 K охлаждают изохорически так, что его давление падает в η = 3 раза. Затем газ расширяют при постоянном давлении до начальной температуры. Найти произведенную газом работу. [ A = 8.3×10 5 Дж ]
32.13. Один моль идеального газа переводят из начального состояния 1 в конечное 4 в процессе, представленном на рис. Какое количество теплоты подвели к газу, если ΔT = Т4 − T1 = 100 K? [ Q = 415 Дж ]
32.14. В вертикальном цилиндре под тяжелым поршнем находится газ при температуре T. Масса поршня m, его площадь S, объем газа V. Для повышения температуры газа на ΔT ему сообщили количество теплоты Q. Найдите изменение внутренней энергии газа. Атмосферное давление po, трения нет. [смотрите ответ в общем файле темы]
32.15. Для нагревания некоторого количества газа с молярной массой M = 28 г/моль на ΔT = 14 K при p = const требуется количество теплоты Q = 10 Дж. Чтобы охладить его на ту же ΔT при V = const требуется отнять Q = 8 Дж. Определить массу газа. [ m ≅ 0.48 г ]
32.16. В вертикальном цилиндре на высоте h от дна находится поршень. Под поршнем — идеальный газ. На поршень положили гирю массой m. После установления теплового равновесия с окружающей средой цилиндр теплоизолировали и газ начали нагревать. Какое количество теплоты следует подвести к газу, чтобы поршень вернулся в исходное положение. Трения нет. [ Q = 5mgh/2 ]
32.17. В вертикальном цилиндре под невесомым поршнем находится гелий. Объем гелия Vo, а давление 3po (po – атмосферное давление). Поршень удерживается сверху упорами (рис.). Какое количество теплоты необходимо отнять у гелия чтобы его объем стал Vo/2. Трения нет. [ Q = 17poVo/4 ]
32.19. Теплоизолированный сосуд объемом V = 22,4 л разделен пополам теплопроводящей перегородкой. В первую половину сосуда вводят m1 = 11,2 г азота при температуре t1 = 20 °С, а во вторую – m2 = 16,8 г азота при t2 = 15 °С. Какое давление установится в первой половине после выравнивания температур? Система теплоизолирована. [ p ≅ 86 кПа ]
32.20. Баллон емкостью V1 содержащий ν1 молей газа при температуре T1, соединяют с баллоном емкостью V2, содержащим ν2 молей того же газа при температуре T2. Какие установятся давление и температура. Система теплоизолирована. [смотрите ответ в общем файле темы]
32.21. Над одним молем идеального газа совершается процесс из двух изохор и двух изобар (рис.). Температуры в точках 1 и 3 равны T1 и T3. Определить работу газа за цикл, если точки 2 и 4 лежат на одной изотерме. [смотрите ответ в общем файле темы]
32.22. Моль идеального газа совершает цикл из двух изохор и двух изобар (рис.). Работа газа за цикл A = 200 Дж. Максимальная и минимальная температуры в цикле отличаются на ΔT = 60 К. Отношение давлений на изобарах равно 2. Найти отношение объемов на изохорах. [ ≅ 3 ]
32.23. Внутри цилиндрического сосуда под поршнем массы m находится идеальный газ под давлением p. Площадь поршня S, внешнего давления нет. Вначале поршень удерживается на расстоянии h1 от дна сосуда (рис.). Поршень отпустили. После прекращения колебаний поршень остановился. На каком расстоянии от дна он остановился? Трения нет. Тепловыми потерями и теплоемкостью поршня и цилиндра пренебречь. [смотрите ответ в общем файле темы]
32.24. В гладкой трубке между двумя поршнями массой m находится один моль идеального газа. В начальный момент скорости поршней направлены в одну сторону и равны v и 3v (рис.), а температура газа To. Найти максимальную температуру газа. Внешнего давления и трения нет. [смотрите ответ в общем файле темы]
32.25. В горизонтальном неподвижном цилиндре, закрытом поршнем массы m, находится один моль идеального газа. Газ нагревают. При этом поршень, двигаясь равномерно, приобретает скорость v. Найдите количество теплоты, сообщенное газу. Теплоемкостью сосуда и поршня, а также внешним давлением пренебречь. [ Q = 5mv 2 /4 ]
32.26. Сосуд, содержащий некоторое количество азота, движется со скоростью v = 100 м/с. На сколько изменится температура азота, если сосуд внезапно остановить? [ ΔT = Mv 2 /(5R) ]
32.27. В гладкой горизонтальной трубе находятся два поршня массами m и 3m. Между поршнями идеальный газ при давлении po. Объем между поршнями Vo (рис.). Первоначально поршни неподвижны, затем их отпускают. Найти максимальные скорости поршней. Труба длинная, внешнего давления нет. [смотрите ответ в общем файле темы]
32.28. Один моль идеального газа изобарически нагрели на ΔT = 72 K, сообщив ему количество теплоты Q = 1,6 кДж. Найти величину γ = cp/cV. [ γ = 1.6 ]
32.29. Вычислить γ = cp/cV для газовой смеси, состоящей из ν1 = 2 молей кислорода и ν2 = 3 молей углекислого газа. [ γ ≅ 1,6]
32.30. Теплоизолированный небольшой сосуд откачан до глубокого вакуума. Окружающая сосуд атмосфера состоит из идеального одноатомного газа при температуре 300 К. В сосуде открывается небольшое отверстие и он заполняется газом. Какую температуру будет иметь газ в сосуде сразу после заполнения? [500 K]
32.31. Определить скорость истечения гелия из теплоизолированного сосуда в вакуум через малое отверстие. Температура газа в сосуде T = 1000 K, скоростью газа в сосуде пренебречь. [ v ≅ 3.3×10 3 м/с]
32.32. Горизонтальный цилиндрический сосуд разделен подвижным поршнем. Справа от поршня одноатомный идеальный газ с параметрами: po; Vo; To, слева – вакуум (рис.). Поршень соединен с левым торцом цилиндра пружиной, собственная длина которой равна длине сосуда. Определить теплоемкость системы в этом состоянии. Теплоемкостью поршня и цилиндра пренебречь. Трения нет. [ C = 2poVo/To ]
32.33. Над идеальным двухатомным газом совершают процесс p = αV (α = const). Какова молярная теплоемкость газа в этом процессе? [c = 3R]
32.34. С одним молем идеального одноатомного газа проводят процесс: p = po — αV, где α – известная константа. Определить, при каких значениях объема газ получает тепло, а при каких отдает. Объем в процессе возрастает.
32.35. В процессе расширения азота его объем увеличился на 2 %, а давление уменьшилось на 1 %. Какая часть теплоты, полученной азотом, была превращена в работу? Удельная теплоемкость азота при постоянном объеме cV = 745 Дж/(кг • К). [ ≅ 0.44 ]
32.36. В цилиндрическом горизонтальном сосуде находится гладкий подвижный поршень. Слева и справа от поршня находится по одному молю идеального одноатомного газа. Температура газа в левой части поддерживается постоянной, а газ в правой части нагревается. Найдите теплоемкость газа в правой части в момент, когда поршень делит сосуд пополам. [C = 2R]
32.37. В вертикальном цилиндре под поршнем площадью S и массой m находится 1 моль идеального одноатомного газа. Под поршнем включается нагреватель, мощность которого N. Определите установившуюся скорость движения поршня. Атмосферное давление po, газ теплоизолирован, трения нет. [смотрите ответ в общем файле темы]
32.38. Мыльный пузырь содержит ν молей идеального одноатомного газа. Определить теплоемкость этой системы. Атмосферное давление не учитывать. [ C = 3νR ]
32.39. По трубе, в которой работает электрический нагреватель, пропускают газ (рис.). Определить мощность нагревателя, если разность температур газа на выходе и на входе равна ΔТ = 5 К, а массовый расход газа μ = 720 кг/ч. Молярная теплоемкость газа при постоянном давлении cp = 29,3 Дж/(моль • К), его молярная масса M = 29 г/моль. [ N ≅ 1.01 кВт ]
32.40. Из небольшого отверстия в баллоне с сжатым гелием вытекает струя гелия со скоростью v. Найдите разность температур гелия в баллоне и в струе. Давление в струе считать равным внешнему давлению, скоростью газа в баллоне пренебречь. [ ΔT = Mv 2 /(5R) ]
32.41. Одинаковые сообщающиеся сосуды закрыты поршнями массой m = 5 кг и M = 10 кг и соединены тонкой трубкой с краном (рис.). Под поршнями идеальный одноатомный одинаковый газ. Сначала кран закрыт, поршень M находится на высоте H = 10 см от дна, а температура одинакова. На какую высоту передвинется поршень m после открытия крана? Система теплоизолирована, атмосферного давления нет. [ 20 см ]
32.42. В горизонтальной открытой трубе сечением S без трения могут двигаться два поршня массами m и M. Начальное расстояние между поршнями l, атмосферное давление po. При закрепленных поршнях воздух между ними откачали, затем поршни отпустили. Какое количество теплоты выделится в результате их абсолютно неупругого столкновения? [ Q = poSl ]
32.43. Один моль идеального газа совершает цикл 1 – 2 – 3 – 1, состоящий из изохоры 1 – 2 и двух процессов, представляемых отрезками прямых в координатах p – V (рис.). Определить работу газа за цикл, если известны: температура T1, Т2 = 4Т1, а также Т2 = Т3. Линия 3 – 1 проходит через начало координат. [ A = 3RT1/2 ]
§3.12. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Задачи на применение газовых законов очень разнообразны. Для их решения нельзя указать какой-либо один определенный прием. Полезными могут оказаться следующие советы.
1. Если согласно условию задачи один из трех параметров (р, V или Т) постоянный, то при Т = const надо применять закон Бойля—Мариотта (3.5.2), при р = const — закон Гей-Люссака (3.7.7), а при V — const — закон Шарля (3.10.2) или (3.10.3).
Если изменяются все три параметра, то следует воспользоваться уравнением состояния в форме (3.9.9) или (3.9.5).
Уравнение состояния (3.9.9) применяется в тех случаях, когда известна масса газа и часть макроскопических параметров в определенном состоянии газа и надо найти неизвестные величины.
Для определения давления смеси газов, не вступающих в химические реакции, используют закон Дальтона (3.8.2).
Во многих задачах требуется построение графиков, изображающих разного рода процессы.
При решении большинства задач надо четко представлять себе, каково начальное состояние системы и какой процесс переводит его в конечное состояние.
Как измерить медицинским термометром температуру тела человека, если температура окружающего воздуха +42 °С?
Решение. Можно предварительно охладить термометр в холодильнике. Если холодильника нет, то нужно подержать термометр 5—8 мин под мышкой, извлечь его и сразу же стряхнуть. Термометр покажет температуру тела, так как ртуть в термометре сожмется при контакте с телом до объема, соответствующего температуре тела.
Газ в цилиндрическом сосуде разделен на две равные части подвижным поршнем, имеющим массу т и площадь сечения S. При горизонтальном положении цилиндра давление газа в каждой половине сосуда равно р.
Решение. При горизонтальном положении цилиндра объем каждой его части обозначим через V (эти объемы равны). При вертикальном положении цилиндра объем верхней части станет равным V + AV, а нижней V
AV. Давление в нижней час- ти цилиндра станет равным + ^г . Согласно закону Бойля— Мариотта
Pl(V + AV) = + ^ у? ¦- AV) = pV.
Исключив из этих равенств ^, получим квадратное уравнение для Pl:
Второй корень квадратного уравнения отрицателен и потому лишен физического смысла.
Поршневой насос при каждом качании захватывает воздух объемом F0. При откачке этим насосом воздуха из сосуда объемом V насос совершил п качаний. Затем другой насос с тем же рабочим объемом V0 начал нагнетать воздух из атмосферы в тот же сосуд, совершив также п качаний. Какое давление установится в сосуде? Температуру воздуха во время работы насоса считать постоянной.
Решение. Согласно закону Бойля—Мариотта при откачке воздуха из сосуда после первого качания давление в сосуде
станет равным Рі = у + у , где р0— атмосферное давление. После второго качания будет выполняться равенство PlV =
= p2(V + У0) и, следовательно, р2 = р01 у + у ] , и т. д. После п
качании в сосуде установится давление рп = + у J ¦
При нагнетании воздуха в сосуд после п качаний давление станет равным
PonVo \( V Y , nVc Р -"
,РonVo \( V Лп , п"о
При любом п р > р0, так как во время нагнетания воздуха при каждом качании насос захватывает воздух, имеющий атмосферное давление р0, а при откачке при каждом качании удаляется воздух при давлении, меньшем р0.
В запаянной с обоих концов цилиндрической трубке находится воздух при нормальных условиях. Трубка разделена подвижным поршнем на две части, объемы которых V1 и V2 относятся как 1 : 2. До какой температуры t1 следует нагреть воздух в меньшей части трубки и до какой t2 охладить в большей, чтобы поршень делил трубку на две равные части, если нагревание и охлаждение в обеих частях трубки производятся
при условии j, = const?
1 1 начальных объемов у- = ^ эти объемы составляют Vl = ^ V0 и
V2 = ^ V0, где V0 — объем всей трубки. Конечные объемы обеих
частей одинаковы и равны V3 = ^ V0.
Согласно закону Гей-Люссака для воздуха в меньшей части трубки выполняется соотношение
а для воздуха в большей части
где Т0 = 273 К — температура, соответствующая начальным условиям. Отсюда
Т1 = = = 410 К, или « +137 °С; v і 1
Т2 = -у-1 = | Г0 в 205 К, или t2 = -68 °С.
В цилиндре под поршнем находится воздух при давлении Pi = 2 • 105Па и температуре = 27 °С. Определите массу т груза, который нужно положить на поршень после нагревания воздуха до температуры t2 = 50 °С, чтобы объем воздуха в цилиндре стал равен первоначальному. Площадь поршня S = 30 см2.
Решение. Так как в процессе нагревания объем воздуха в цилиндре не изменяется, то согласно закону Шарля имеем
Подставляя в (3.12.1) выражение дляр2, получим
Pi = mg Т2' Р1 + -д
Найдите среднюю (эффективную) молярную массу сухого атмосферного воздуха, предполагая известный процентный состав воздуха по массе: азот — пг = 75,52%, кислород — п2 = 23,15%, аргон — п3 = 1,28% и углекислый газ— п4 = = 0,05%.
Решение. Для каждого газа можно записать уравнение состояния:
pxV = RT, p2V = ^ RT, p3V = ^ RT, PiV = j± RT.
Здесь Mi, M2, M3 и M4 — молярные массы соответственно азота, кислорода, аргона и углекислого газа.
Складывая правые и левые части этих уравнений, получим
Для смеси газов выполняется соотношение
где m = mx + m2 + m3 + m4 — масса воздуха с объемом V, а М — искомая эффективная молярная масса.
Сравнивая уравнения состояния (3.12.2) и (3.12.3), получим М =
ТП2 + тп2 + ТПд + ТП^ ТП-у ТП2 ТП§ ТПд
м[ + м2 + м3 + Жі Разделив числитель и знаменатель на m и умножив на 100%, получим выражение для М через процентный состав воздуха по массе
м = і ? 2 і— = 28,966 • 10"3 кг/моль =
Закрытый с обоих концов цилиндр наполнен газом при давлении р — 100 кПа и температуре t = 30 °С и разделен подвижным теплонепроницаемым поршнем на две равные части длиной L по 50 см. На какую величину AT нужно повысить температуру газа в одной половине цилиндра, чтобы поршень сместился на расстояние I = 20 см, если во второй половине цилиндра температура не изменяется? Определите давление газа после смещения поршня.
Решение. Для газа в части цилиндра с постоянной температурой применим закон Бойля—Мариотта:
pLS = p1(L-l)S, (3.12.4)? где S — площадь основания цилиндра. Для нагреваемой части цилиндра запишем уравнение Клапейрона:
В уравнениях (3.12.4) и (3.12.5)— давление газа после смещения поршня, одинаковое в обеих частях цилиндра вследствие равновесия поршня, а. Т + AT в уравнении (3.12.5) — температура газа в нагретой части цилиндра.
Разделив почленно уравнение (3.12.4) на уравнение (3.12.5), получим
AT = jfri = 404 К-
Из уравнения (3.12.4) находимр^х
Сосуд объемом V = 100 л разделен пополам полупроницаемой перегородкой. В начальный момент времени в одной половине сосуда находился водород, масса которого тп1 = 2 г, а во второй — 1 моль азота. Определите давления, установившиеся по обе стороны перегородки, если она может пропус-кать только водород. Температура в обеих половинах одинакова и постоянна: t = 127 °С.
Решение. Так как водород свободно проходит через перегородку, то он распространяется по всему сосуду. Запишем уравнение Менделеева—Клапейрона для водорода после установления состояния равновесия:
3 кг/моль — молярная масса водорода.
В той части сосуда, в которой вначале был только водород, он и в дальнейшем останется в чистом виде, так что давление в этой части сосуда станет равным
Для азота уравнение Менделеева—Клапейрона имеет вид
где р2 — давление азота.
Так как в этой половине находятся водород и азот, то полное давление р согласно закону Дальтона складывается из парциальных давлений и р2, т. е.
Гелий массой 20 г, заключенный в теплоизолированном цилиндре под поршнем, медленно переводится из состояния 1 с объемом Vy = = 32 л и давлением рх = 4,1 атм в состояние 2 с объемом V2 = 9 л и давлением р2 = 15,5 атм. Какой наибольшей температуры достигнет газ при этом процессе, если на графике зависимости давления газа от объема процесс изображается прямой линией (рис. 3.18)?
Решение. Как следует из рисунка 3.18, давление и объем газа связаны линейной зависимостью: р = aV + b, где а и b — постоянные коэффициенты. Из условий задачи получаем систему уравнений
Pi = + b, р2 = aV2 + b. Решив эту систему относительно а и Ъ, найдем г / \ \ / \ / \ / \ / \ / \ / \ / \
а = ^—гт- « -0,5 атм/л, м
PlV2 „ Ъ = —Ї7—— = 20 атм. "і
V2 Подставив в уравнение Менделеева—Клапейрона вместо р выражение aV + Ъ, получим (3.12.6)
aV2 + bV= RT = const • Т. М График зависимости Т от V представляет собой параболу
(рис. 3.19). Кривая достигает максимума при Fmax = = = 20 л, когда корни квадратного уравнения (3.12.6) совпадают. При этом
Апах = + Ъ r95" style="margin:10px 5px; width: 100%;min-height:280px;">
Рис. 3.21 Уравнение (3.12.8) — это уравнение параболы, ось симметрии которой совпадает с осью Т. Следовательно, в координатах V, Т искомый график имеет вид, показанный на рисунке 3.21, а. Аналогично получим график этого процесса в координатах р, Т (рис. 3.21, б).
Вы надули щеки. При этом и давление, и объем воздуха во рту увеличиваются. Как это согласуется с законом Бойля— Мариотта?
Чтобы измерить температуру человеческого тела, приходится держать термометр под мышкой в течение 5—8 мин.
В то же время стряхнуть его можно практически сразу после измерения температуры. Почему?
Узкая вертикальная трубка длиной L, закрытая с одного конца, содержит воздух, отделенный от наружного воздуха столбиком ртути длиной h. Плотность ртути равна р. Трубка расположена открытым концом вверх. Какова была длина I столбика воздуха в трубке, если при перевертывании трубки открытым концом вниз из трубки вылилась половина ртути? Атмосферное давление равно р0.
В ртутный барометр попал пузырек воздуха, вследствие чего барометр показывает давление меньше истинного. При давлении рх = 768 мм рт. ст. уровень ртути расположен на высоте hх = 748 мм, причем длина пустой части трубки I = = 80 мм. Каково атмосферное давление р2, если ртуть стоит на высоте h2 = 734 мм? Плотность ртути р = 1,36 • 104 кг/м3.
Площадь сечения цилиндра автомобильного насоса S = = 10 см2. Определите длину I цилиндра, если известно, что для накачки шины объемом V = 0,02 м3 от давления р0 = = 1 • 105Па до давления р = 3 • 105Па требуется совершить п = 100 качаний. Утечкой и нагреванием воздуха пренебречь.
В цилиндре под поршнем находится воздух. Поршень имеет форму, показанную на рисунке 3.22. Масса поршня т = 6 кг, площадь сечения цилинд-ра S = 20 см2. Атмосферное давление р0 — 105Па. Найдите массу т1 груза, который надо положить на поршень, чтобы объем Vx воздуха в цилиндре уменьшился в 2 раза. Трение не учитывать. Температура постоянна.
Газ нагрет от температуры t1 = 27 °С до температуры t2 = 39 °С. На сколько процентов увеличился его объем, если давление осталось неизменным?
Вертикальный цилиндр, закрытый подвижным поршнем, содержит газ массой т — 0,012 кг. При температуре = = 177 °С объем газа равен Vx = 4 л. При какой температуре t2 плотность этого газа будет равна р2 = 5,3 кг/м3?
Открытую стеклянную колбу, имеющую форму шара радиусом г = 2 см с горлышком длиной I = 10 см и диамет- ром d = 1 см, нагрели до температуры tlt а затем погрузили целиком в воду горлышком вниз. При охлаждении колбы вода вошла в горлышко. Когда температура колбы стала равной 12 = 13 °С, ее начали приподнимать из воды, не переворачивая, так чтобы шарообразная часть оказалась над водой, а горлышко — частично погруженным в воду. При этом, когда уровень воды в горлышке и в сосуде совпал, под водой осталась половина горлышка. Какова была температура t]_, до которой нагрели колбу?
Манометр на баллоне с газом в помещении с температурой t]_ = 17 °С показывает давление р = 240 кПа. На улице показание манометра уменьшилось на Ар = 40 кПа. Найдите температуру наружного воздуха, если атмосферное давление р0 = 100 кПа.
Два сосуда одинаковой вместимости содержат воздух, один при температуре 7\ и давлении pj, другой при температуре 2^2 и давлении р2. Сосуды соединили тонкой трубкой и после выравнивания давлений и температур воздух нагрели до температуры Т. Какое давление установится после нагревания?
Шар-зонд заполнен газом при температуре = 27 °С до давления Рх = 105 кПа. После подъема шара на высоту, где давление р0 = 80 кПа, объем шара увеличился на п = 5% и давление в нем стало отличаться от внешнего на Ар = 5 кПа. Определите температуру воздуха на этой высоте, предполагая, что газ в шаре приобрел температуру окружающего воздуха.
Из баллона со сжатым углекислым газом из-за неисправности вентиля вытекает газ. Вместимость баллона V = = 10 л. При температуре Тj = 263 К манометр показывал давление pj = 9,3 атм, а через некоторое время при температуре Т2 = 295 К манометр показывал давление р2 = = 9,4 атм. Чему равна масса тп газа, вытекшего из баллона за это время?
Газ последовательно переводится из состояния 1 с температурой Тj в состояние 2 с температурой Т2, а затем в состояние 3 с температурой Г3 и возвращается в состояние 1. Определите температуру Г3, если процессы изменения со-
стояния происходили так, как это показано на графике (рис. 3.23), а температуры и Т2 известны.
В баллоне вместимостью V — 10 л содержится водород при температуре t = 20 °С под давлением р = 107 Па. Какая масса водорода была выпущена из баллона, если при полном сгорании оставшегося газа образовалось m = 50 г во-ды?
В баллоне вместимостью V = 10 л находился гелий под давлением рх = 10 атм при температуре = 27 °С. После того как из баллона был выпущен газ массой m = 10 г, температура в баллоне была понижена до t2 = 17 °С. Определите давление гелия, оставшегося в баллоне.
Молекулярный водород некоторой массы занимает объем Vl = 1 м3 при температуре Тх = 250 К и давлении рх
= 2 • 105Па. Какое давление водород будет создавать при температуре Т2 = 5000 К и объеме V2 = 10 м3, если при столь высокой температуре молекулы водорода полностью диссоциируют на атомы?
Два сосуда объемом V1 = 200 см3 и V2 = 100 см3, наполненные кислородом при температуре t = 2 7 °С под давлением р0 — 760 мм рт. ст., соединены трубкой, внутри которой находится теплоизолирующая пористая перегородка, обеспечивающая одинаковость давлений в сосудах. Затем первый сосуд нагрели до температуры = 100 °С, а второй
охладили до температуры t2 — О °С. Определите установившееся в системе давление.
Изобразите на графиках в координатах р, V; р, Т и V, Т изотермический процесс для одного моля газа при Т =
Изобразите на графиках в координатах р, V; р, Т и V, Т изобарный процесс: 1) для р = J5j ир = 2;р1г если v = 1 моль; 2) для р = р1( если v = 3 моль.
21. На рисунке 3.24 показан график изменения состояния идеального газа в координатах р, V. Представьте этот процесс на графиках в координатах V, Тир, Т.
Читайте также:

