какое давление будет оказывать газ на стенки цилиндра при температуре 700 к и концентрации молекул
Обновлено: 26.04.2024
Повторительно - обобщающий урок по темам: «Основы МКТ», «Свойство газов».

Повторительно-обобщающий урок по темам: «Основы МКТ», «Свойство газов».
Тип урока: « Урок-соревнование»
Цели урока: Образовательные: систематизировать знания учащихся по МКТ
на основе структуры физической теории; повторить основные
понятия и закономерности МКТ; закрепление навыков решения
задач (расчетных, качественных, экспериментальных).
Воспитательные: формирование навыков коллективной работы
Развивающая: научить учащихся применять теоретические
знания на практике; продолжить работу над развитием речи;
научить слушать и оценивать ответ учащихся.
| Вложение | Размер |
|---|---|
| urok_-_sorevnovanie_osnovy_mkt.docx | 24.86 КБ |
Предварительный просмотр:
Общая тема: «Свойство газов», «Основы МКТ».
Тема урока : Повторительно-обобщающий урок по темам: «Основы МКТ»,
Тип урока: « Урок-соревнование»
Цели урока: Образовательные: систематизировать знания учащихся по МКТ
на основе структуры физической теории; повторить основные
понятия и закономерности МКТ; закрепление навыков решения
задач (расчетных, качественных, экспериментальных).
Воспитательные: формирование навыков коллективной работы
Развивающая: научить учащихся применять теоретические
знания на практике; продолжить работу над развитием речи;
научить слушать и оценивать ответ учащихся.
Оборудование: карточки к уроку; формулы к стенду «Сегодня на уроке»;
сигнальные карточки, таблица «Построение структуры МКТ;
и дополнительно: стеклянная пластина, подвешенная на
резиновом шнуре, емкость с водой, штатив.
Межпредметные связи: 1. математика: «Свойство пропорции»; «Решение
уравнений», «Свойства степени».
2. история: «Античная эпоха в истории человечества».
I. Организационный момент:
1. Проверка отсутствующих и готовность к уроку
2. Прием творческих домашних заданий:
II. Экспресс-контроль на личное первенство (учитель зачитывает вопросы, а учащиеся отвечают).
2). Обобщаем знания по изученной теме:
То, что утверждали античные философы более 2000 лет назад, дошли до нас благодаря поэту Титу Лукрецию Кару. На уроках «Всеобщей истории» вы слышали об этом человеке, когда изучали тему: «Античная эпоха в истории человечества». Он писал:
… Выслушай то, что скажу, и ты сам несомненно признаешь,
Что существуют тела, которых мы видеть не можем…
… Стало быть, ветры – тела, но только незримые нами.
… Далее, запахи мы обоняем различного рода,
Хоть и не видим совсем, как в ноздри они проникают…
… И, наконец, на морском берегу, разбивающем волны,
Платье сыреет всегда, а на солнце, вися, оно сохнет,
Видеть, однако, нельзя, как влага на нем оседает,
Как и не видно того, как она исчезает от зноя.
Значит, дробится вода на такие мельчайшие части,
Что недоступны они совершенно для нашего глаза.
- Сегодня, мы с вами, подведем итог построения структуры молекулярно-кинетической теории.
Мы знаем, что в ядро теории входят: законы, принципы, положения, постулаты, фундаментальные постоянные. А следствием служат частные законы: уравнение состояния идеального газа, уравнение Менделеева - Клапейрона, газовые законы.
Построение структуры молекулярно-кинетической теории.
Вопрос: Какие основные положения молекулярно-кинетической теории помогают вспомнить это стихотворение?
Ответы: 1). Все тела состоят из частиц (молекул), между которыми есть
2). (молекулы) частицы хаотически движутся;
3). частицы (молекулы) взаимодействуют друг с другом
(притягиваются или отталкиваются, в зависимости от расстояния
Вопрос: Какое уравнение лежит в основе молекулярно-кинетической
Найти его на стенде и прочитать!
Ответ: Основное уравнение молекулярно-кинетической теории:
Вопрос: Какая формула связывает температуру и среднюю кинетическую энергию поступательного движения молекул?
Вопрос: О каких постоянных необходимо помнить.
Ответ: Постоянная Больцмана:
Вопрос: Как связано давление с концентрацией и абсолютно температурой.
Какая это формула?
Ответ: Эту связь между давлением, концентрацией и абсолютной температурой описывает уравнение состояния идеального газа.
Вопрос: В каком виде надо запомнить уравнение Менделеева-Клапейрона?
Вопрос: Для какой массы газа формула справедлива?
Ответ: Формула справедлива для произвольной массы.
Кто дополнить? Зная количество вещества
Вопрос: Вспомним газовые законы.
а) 1. Какой это закон?
Ответ: 1. Это закон Бойля-Мариотта.
2. Для газа данной массы произведение давления газа на его объем
постоянно, если температура газа не меняется.
- Какой это закон?
- Сформулируйте его.
Ответ: 1. Закон Гей-Люссака.
2. Для газа данной массы отношение объема к температуре
постоянно, если давление газа не меняется.
1. Какой это закон?
2. Прочитайте закон.
1. Это закон Шарля.
2. Для газа данной массы отношение давления к температуре постоянно, если объем не меняется.
Подводя итог, я могу выделить учащихся, которые твердо усвоили тему.
III. Следующим этапом нашего урока будет «Трудный подъем».
Здесь предстоит решать задачи.
№ 1 Какова средняя квадратическая скорость движения молекул газа,
(457 Р.) имеющего массу 6 кг и занимающего объем 5 м³ при давлении
№ 2. Чему равна средняя кинетическая энергия хаотического поступательного движения молекул газа при температуре 127°С.
Ответ: 8,28 * 10 -21 Дж.
№ 3. Какое давление будет оказывать газ на стенки цилиндра при температуре 700 К и концентрации молекул 2,7*10 26 м -3 ?
Ответ: 2608,2 * 10 3 Па.
IV Анализируя этапы урока «Экспресс-конкурс на личное первенство» и «Трудный подъем», можно создать команду: «Знатоков». В нее войдут лучшие учащиеся:
Проведем конкурс: «Кто быстрее?», в котором будут участвовать три команды: изотерма, изобара, изохора.
Ответив на один вопрос, команда может заработать 5 баллов.
За нарушение дисциплины команде будут заданы «штрафные задачи»
1. Определить основную физическую величину, входящую в формулу основного уравнения молекулярно-кинетической теории газа?
Определить с помощью функции φ(vх) давление газа на стенку, если температура газа Т и концентрация молекул n.

Готовое решение: Заказ №10201

Тип работы: Задача

Статус: Выполнен (Зачтена преподавателем ВУЗа)

Предмет: Физика

Дата выполнения: 16.11.2020

Цена: 119 руб.
Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Определить с помощью функции φ(vх) давление газа на стенку, если температура газа Т и концентрация молекул n.
Основное соотношение, определяющее смысл одномерной функции распределения Максвелла по проекциям скорости молекул на произвольную координатную ось Х :
- количество молекул в единице объема, у которых проекция скорости лежит в диапазоне от до пропорционально полному количеству молекул в единице объема, пропорционально ширине диапазона скоростей и зависит от самой величины :
Вероятность события, состоящего в том, что скорость произвольной молекулы лежит в диапазоне от до , равна

Присылайте задания в любое время дня и ночи в whatsapp.
- Готовые заказы по всем предметам
- Готовые заказы по высшей математике
- Готовые заказы по физике
- Готовые заказы по химии
- Готовые заказы по экономике
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Сайт предназачен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Давление газа на стенки сосуда

В жизни мы встречаем газообразное состояние вещества, когда чувствуем запахи. Запах очень легко распространяется, потому что газ не имеет ни формы, ни объема (он занимает весь предоставленный ему объем), состоит из хаотично движущихся молекул, расстояние между которыми больше, чем размеры молекул.
Давление газа
Мы только что выяснили, что молекулы газа беспорядочно движутся. Во время движения они сталкиваются друг с другом, а также со стенками сосуда, в котором этот газ находится. Поскольку молекул много, ударов тоже много.
Например, в комнате, в которой вы сейчас находитесь, на каждый квадратный сантиметр за 1 с молекулами воздуха наносится столько ударов, что их количество выражается двадцати трехзначным числом.
Хотя сила удара отдельной молекулы мала, действие всех молекул о стенки сосуда приводит к значительному давлению. Это как если бы один комар толкал машину, то она бы и не сдвинулась с места, а вот пару сотен миллионов комаров вполне себе способны эту машину сдвинуть.

Зависимость давления от других величин
Зависимость давления от объема
В механике есть формула давления, которая показывает: давление прямо пропорционально силе и обратно пропорционально площади, на которую эта сила оказывается.
Давление
p = F/S
p — давление [Па]
F — сила [Н]
S — площадь [м^2]
То есть, если наши двести миллионов комаров будут толкать легковую машину, они распределятся по меньшей площади, чем если бы они толкали грузовой автомобиль (просто потому что легковая меньше грузовика).
Из формулы давления следует, что давление на легковой автомобиль будет больше из-за меньшей площади.
Давайте рассмотрим аналогичный пример с двумя сосудами разной площади.

Давление в левом сосуде будет больше, чем во втором, по аналогичной схеме — потому что площадь меньше. Но если площадь основания меньше, то и объем меньше. Это значит, что давление будет зависеть от объема следующим образом: чем больше объем, тем меньше давление — и наоборот.
При этом зависимость будет не линейная, а примет вот такой вид (при условии, что температура постоянна):

Такая зависимость называется законом Бойля-Мариотта.
Она экспериментально проверяется с помощью такой установки.

Объем шприца увеличивают с помощью насоса, а манометр измеряет давление. Эксперимент показывает, что при увеличении объема давление действительно уменьшается.
Зависимость давления от температуры
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Эти исследования были впервые произведены в Жаком Шарлем.
Газ нагревался в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Пренебрегая ничтожным увеличением объема колбы при нагревании и незначительным изменением объема при смещении ртути в узкой манометрической трубке.
Таким образом, можно считать объем газа неизменным. Подогревая воду в сосуде, окружающем колбу, измеряли температуру газа по термометру, а соответствующее давление — по манометру.

Этот эксперимент показал, что давление газа увеличивается с увеличением температуры. Это связано с тем, что при нагревании молекулы газа движутся быстрее, из-за чего чаще ударяются о стенки сосуда.
С температурой все проще. Зависимость давления от температуры при постоянных объеме и массе будет линейно:

Эта зависимость называется законом Шарля.
Хранение и транспортировка газов
Если нужно перевезти значительное количество газа из одного места в другое, или когда газы необходимо длительно хранить — их помещают в специальные прочные металлические сосуды. Из-за того, что при уменьшении объема увеличивается давление, газ можно закачать в небольшой баллон, но он должен быть очень прочным.
Сосуды, предназначенные для транспортировки газов, выдерживают высокие давления. Поэтому с помощью специальных насосов (компрессоров) туда можно закачать значительные массы газа, которые в обычных условиях занимали бы в сотни раз больший объем.
Поскольку давление газов в баллонах даже при комнатной температуре очень велико, их ни в коем случае нельзя нагревать. Например, держать под прямыми лучами солнца или любым способом пытаться сделать в них отверстие, даже после использования.
§ 4.9. Примеры решения задач
При решении задач на применение молекулярно-кинетической теории идеального газа используются основное уравнение кинетической теории газов в форме (4.4.9) или (4.4.10) и вытекающие из него выражения для средней кинетической энергии молекул (4.5.5) и средней квадратичной скорости (4.7.2) или (4.7.3). Значительное количество задач удобно решать, используя формулу (4.5.6), связывающую давление газа с концентрацией молекул и абсолютной температурой. Внутренняя энергия идеальных одноатомных газов (например, инертных газов) вычисляется по формуле (4.8.1).
Чему равна масса газа, содержащегося в закрытом цилиндре вместимостью V = 0,5 л, если давление газа р = 5 • 10 5 Па, а средняя квадратичная скорость молекул = 500 м/с?
Решение. Согласно основному уравнению молекулярно-кинетической теории
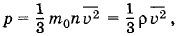
где ρ = m0n — плотность газа. Но ρ = , где m — масса газа, а V — его объем. Поэтому
В воздухе при t = 27 °С взвешены пылинки сферической формы. Радиус пылинок r = 10 -6 м. Плотность вещества пылинок ρ = 1,3 • 10 3 кг/м 3 . Определите средний квадрат скорости пылинок.
Решение. Пылинки принимают участие в броуновском движении. Средний квадрат скорости пылинки
где mб — масса пылинки. Следовательно,
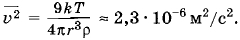
В сосуде находится 1 л воды при температуре 27 °С. Каким стало бы давление внутри сосуда, если бы силы взаимодействия между молекулами внезапно исчезли?
Решение. При исчезновении сил взаимодействия между молекулами вода превратилась бы в идеальный газ. Давление можно найти по уравнению состояния идеального газа:
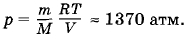
Два сосуда, содержащих различные газы, соединены трубкой с краном. Давление газа в первом сосуде p1, а число молекул N1. Давление газа во втором сосуде р2, число молекул N2. Какое давление установится в сосудах, если открыть кран соединительной трубки? Температуру считать постоянной.
Решение. Согласно формуле (4.5.6)
(здесь V1 и V2 — объемы сосудов). Следовательно,
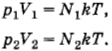
После того как кран будет открыт, давления выравняются и искомое давление согласно той же формуле (4.5.6) определится уравнением
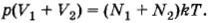
Подставляя сюда выражения для объемов из предыдущих формул, получим
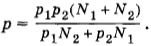
Плотность газа в баллоне газополной электрической лампы ρ = 0,9 кг/м 3 . При горении лампы давление в ней возросло с р1 = 8 • 10 4 Па до р2 = 1,1 • 10 5 Па. На сколько увеличилась при этом средняя квадратичная скорость молекул?
Решение. Плотность газа ρ = m0n, и основное уравнение мо-лекулярно-кинетической теории можно записать в форме
- При какой температуре молекулы кислорода имеют такую же среднюю квадратичную скорость, что и молекулы азота при температуре 100 °С?
- На стенку площадью S налетает поток молекул со средней скоростью . Число молекул, движущихся по направлению к стенке, в единице объема n0, масса каждой молекулы m0. Найдите действующую на стенку силу и давление, если молекулы движутся перпендикулярно стенке и удары молекул о стенку абсолютно неупругие.
- Какое давление на стенки сосуда производит водород, если число молекул в 1 см 3 равно 4,1 • 10 18 , а средняя квадратичная скорость его молекул 2400 м/с?
- Определите число молекул кислорода в 1 м 3 , если давление равно 77 кПа, а средняя квадратичная скорость его молекул 400 м/с.
- Определите плотность газа, молекулы которого производят на стенки сосуда давление 1,6 • 10 5 Па. Средняя квадратичная скорость молекул 800 м/с.
- Какова средняя квадратичная скорость молекул газа, который занимает объем 1,3 м 3 при давлении 5 • 10 4 Па? Масса газа 60 г.
- В цилиндре вместимостью 1,2 л содержится газ под давлением 10 5 Па. Среднее значение кинетической энергии каждой молекулы равно 6 • 10 -21 Дж. Сколько молекул газа находится в цилиндре?
3.4. Распределение молекул по координатам
В этом разделе мы перейдем теперь к анализу распределения молекул газа по координатам. Очевидно, что если на молекулы газа не действуют внешние силы, то, в состоянии термодинамического равновесия, газ равномерно распределен по заданному объему. В этом случае давление и плотность газа одинаковы во всех точках. Если же газ находится в силовом поле (как, например, атмосферный воздух, который испытывает притяжение Земли), то давление и плотность газа уже не будут всюду одинаковыми, а будут меняться от точки к точке.
Барометрическая формула. Найдем закон, по которому изменяется давление атмосферы (или плотность воздуха) по мере удаления от поверхности Земли. Выделим вертикальный столб воздуха с площадью горизонтального сечения S.
Атмосферное давление на высоте h обусловлено весом вышележащих слоев газа. Пусть на высоте h давление р, тогда на высоте h + dh давление р + dp (рис. 3.6). При этом, если dh > 0, то давление уменьшается, dp < 0, так как уменьшается вес вышележащих слоев атмосферы.

Рис. 3.6. Вертикальный воздушный цилиндр (к выводу барометрической формулы)
Выделенный слой газа, высотой dh и массой m, находится в равновесии. Следовательно, сумма действующих на него сил равна нулю:
В проекции на вертикальную ось получаем
где r — плотность газа на высоте h. Раскрывая скобки и приводя подобные члены, переходим к уравнению
Воспользуемся уравнением Клапейрона — Менделеева для выделенной массы газа m и выразим плотность через давление:
Подставляя (3.47) в (3.46), окончательно получаем
Это уравнение можно проинтегрировать в случае изотермической атмосферы (Т = const):
Постоянная интегрирования р0 равна давлению на поверхности (h = 0). Полученная зависимость называется барометрической формулой. Она описывает распределение давления газа по высоте в однородном поле тяжести при постоянной температуре. Следует обратить внимание на то, что распределение зависит от рода газа. Чем меньше m, тем меньше по абсолютной величине показатель степени, и тем медленнее для такого газа уменьшается давление при увеличении высоты. На рис. 3.7 показаны зависимости давления от высоты при температуре Т = 300 К (27 °С) для трех газов различной молярной массы — водорода Н2 (m1 = 2,016 г/моль), азота N2 (m2 = 28,013 г/моль) и кислорода 02 (m3 = 31,999 г/моль).
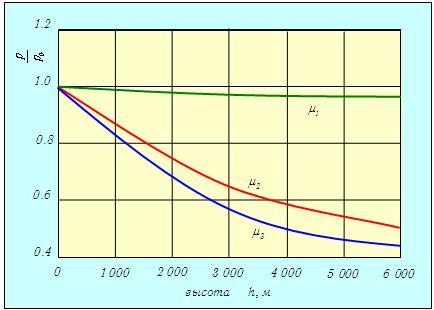
Рис. 3.7. Зависимость давления трех разных газов Н2, N2 и O2 от высоты
Пример. Определим, на какой высоте давление кислорода уменьшается в два раза (при Т = 300 К).
Применяем барометрическую формулу.
Используя уравнение идеального газа в форме
из барометрической формулы легко получить закон изменения с высотой числа n молекул в единице объема:
Из (3.51) следует, что состав воздуха с ростом высоты будет меняться количественно: возрастет концентрация газов с малой молярной массой, например водорода и гелия.
У поверхности воздух представляет собой смесь газов: N2 — 78,08 %, O2 — 20,95 %, СO2 — 0,03 %, инертные газы — 0,94 %. Посмотрим, как изменится отношение концентраций кислорода и азота в изотермической атмосфере (Т = 300 К) на высоте 10 км.
Отношение концентраций кислорода и азота уменьшится от 0,27 до 0,23. Наш расчет справедлив лишь для изотермической атмосферы и сравнительно небольших высот, для которых ускорение свободного падения изменяется незначительно: g = const, T = const.
Распределение Больцмана. Число молекул в единице объема зависит от высоты h и температуры Т, причем обе переменные входят в показатель экспоненты. Уравнение (3.51) можно записать в виде
где kB — масса одной молекулы газа. При этом выражение m0gh, стоящее в числителе, есть не что иное, как потенциальная энергия одной молекулы в поле тяжести Земли. Поэтому можно говорить, что мы имеем распределение молекул по значениям потенциальной энергии. При этом чем больше потенциальная энергия, тем меньше таких молекул. В знаменателе показателя степени стоит kBТ — величина, пропорциональная средней энергии теплового движения молекулы. Чем выше температура, то есть чем больше энергия теплового движения молекул, тем экспоненциальный множитель, пропорциональный концентрации молекул, с ростом высоты убывает медленнее. На рис. 3.8 показаны кривые относительной концентрации молекул кислорода O2 на разных высотах при двух различных температурах Т1 = 300 К и Т2 = 1 300 К (последний случай, конечно, нереален и используется лишь как иллюстрация).

Рис. 3.8. Зависимость относительной концентрации молекул кислорода от высоты при разных температурах T1 = 300 K и T2 = 1 300 K
Видно, что число частиц в единице объема при большей температуре медленнее убывает с высотой. При уменьшении температуры большая часть частиц располагается на меньшей высоте. А при Т = 0 все частицы расположились бы на поверхности Земли. Этот факт имеет простое физическое объяснение. Каждое конкретное распределение молекул по высоте устанавливается в результате действия двух тенденций:
то есть концентрация молекул больше там, где меньше их потенциальная энергия. Частицы будут с большей вероятностью располагаться в тех точках пространства, где потенциальная энергия меньше.
Больцман доказал, что такое распределение осуществляется в поле любых сил, а не только в гравитационном поле. Поэтому распределение (3.53), где n — концентрация частиц с потенциальной энергией Ер называется распределением Больцмана.
Каждый школьник знает, что газ является одним из четырех (включая плазму) агрегатных состояний материи, в котором частицы не имеют определенных положений и движутся хаотичным образом во всех направлениях с одинаковой вероятностью. Исходя из такого строения, газы не сохраняют ни объем, ни форму при малейшем внешнем силовом воздействии на них.
В любом газе средняя кинетическая энергия его частиц (атомов, молекул) больше, чем энергия межмолекулярного взаимодействия между ними. Кроме того, расстояния между частицами намного превышают их собственные размеры. Если молекулярными взаимодействиями и размерами частиц можно пренебречь, тогда такой газ называется идеальным.
В идеальном газе существует лишь единственный вид взаимодействия — упругие столкновения. Поскольку размер частиц пренебрежимо мал в сравнении с расстояниями между ними, то вероятность столкновений частица-частица будет низкой. Поэтому в идеальной газовой системе существуют только столкновения частиц со стенками сосуда.
Все реальные газы с хорошей точностью можно считать идеальными, если температура в них выше комнатной, и давление не сильно превышает атмосферное.
Физика 7 класс. Давление газа и жидкости. Закон Паскаля.
Физика 7 класс. Конспект. Давление газа
Давление газа. Передача давления жидкостями и газами. Закон Паскаля. Расчет давления жидкости.
Задачи на тему Давление
Газы, в отличие от твердых тел и жидкостей, заполняют весь сосуд, в котором находятся.
Пример:
баллон для хранения газа, камера автомобильной шины, волейбольный мяч
Газ, находясь в каком-либо сосуде, оказывает давление на стенки, дно и крышку тела, в котором находится. Молекулы газа беспорядочно движутся, сталкиваясь друг с другом и со стенками сосуда, внутри которого находятся. Давление газа на стенки сосуда (и на помещенное в газ тело) вызывается ударами молекул газа.
При уменьшении объема газа его давление увеличивается, а при увеличении объема давление уменьшается при условии, что масса и температура газа остаются неизменными.
Давление газа в закрытом сосуде тем больше, чем выше температура газа, при условии, что масса газа и объем не изменяются.
Из опытов получен общий вывод, что давление газа тем больше, чем чаще и сильнее молекулы ударяют о стенки сосуда.
Давление, производимое на жидкость или газ, передается в любую точку без изменений во всех направлениях.

Опыт иллюстрирует закон Паскаля
Свойство газов передавать давление используют в технике при устройстве различных пневматических машин и инструментов.
Примеры:
отбойный молоток, пескоструйные аппараты, электропневматические тормоза в железнодорожных вагонах
На жидкости, как и на все тела на Земле, действует сила тяжести. Поэтому каждый слой жидкости, налитой в сосуд, своим весом создает давление на другие слои, которое по закону Паскаля передается по всем направлениям. Следовательно, внутри жидкости существует давление.
Опыты подтверждают, что внутри жидкости существует давление и на одном и том же уровне оно одинаково по всем направлениям. С глубиной давление увеличивается.

Давление жидкости на дно и стенки сосуда зависит только от плотности и высоты столба жидкости.
Расчет давления жидкости на дно и стенки сосуда:
где p – давление (Па), ρ – плотность жидкости (кг/м3), h– высота столб жидкости (м), g– ускорение свободного падения (Н/кг).
Сосуды, соединенные между собой (например, чайник, лейка и т.п.), называют сообщающимися.
В сообщающихся сосудах любой формы и сечения поверхности однородной жидкости устанавливаются на одном уровне (при условии, что давление воздуха над жидкостью одинаково).
При равенстве давлений высота столба жидкости с большей плотностью будет меньше высоты столба с меньшей плотностью.
Конспект составлен на основании теоретического материала учебника «Физика 7 класс» А.В. Перышкин
Похожие записи:
Когда вы производите большее давление на лед: на коньках или без коньков?
Давление в водопроводе 4·105 Па. С какой силой давит вода на пробку, закрывающую отверстие трубы, ес…
Для выпуска расплавленного металла из литейного ковша делают на дне ковша отверстие, закрываемое спе…
В U-образную трубку налиты ртуть, вода и керосин (рис. 56). Высота столба воды равна 20 см, а уровен…
Причина возникновения давления в газах

Прежде чем записать формулы расчета давления газа, необходимо разобраться, почему оно возникает в изучаемой системе.
Согласно физическому определению, давление – это величина, равная отношению силы, которая перпендикулярно воздействует на некоторую площадку, к площади этой площадки, то есть:
Выше мы отмечали, что существует только один единственный тип взаимодействия в идеальной газовой системе – это абсолютно упругие столкновения. В результате них частицы передают количество движения Δp стенкам сосуда в течение времени соударения Δt. Для этого случая применим второй закон Ньютона:
Именно сила F приводит к появлению давления на стенки сосуда. Сама величина F от столкновения одной частицы является незначительной, однако количество частиц огромно (≈ 1023), поэтому они в совокупности создают существенный эффект, который проявляется в виде наличия давления в сосуде.
Давление газа на стенки сосуда
Двигаясь хаотично в пространстве, молекулы газа сталкиваются между собой и со стенками сосуда, в котором находятся. Сила удара одной молекулы мала. Но так как молекул очень много, и сталкиваются они с большой частотой, то, действуя сообща на стенки сосуда, они создают значительное давление. Если в газ помещено твёрдое тело, то оно также подвергается ударам молекул газа.
Проведём несложный опыт. Под колокол воздушного насоса поместим завязанный воздушный шарик, не полностью наполненный воздухом. Так как воздуха в нём мало, шарик имеет неправильную форму. Когда же мы начнём откачивать воздух из-под колокола, шарик станет раздуваться. Через некоторое время он примет форму правильного шара.
Что же произошло с нашим шариком? Ведь он был завязан, следовательно, количество воздуха в нём осталось прежним.
Всё объясняется довольно просто. Во время движения молекулы газа сталкиваются с оболочкой шарика снаружи и внутри него. Если воздух откачивается из колокола, молекул становится меньше. Уменьшается плотность, а значит и частота ударов молекул о наружную оболочку также уменьшается. Следовательно, давление снаружи оболочки падает. А так как внутри оболочки число молекул осталось прежним, то внутреннее давление превышает наружное. Газ давит изнутри на оболочку. И по этой причине она постепенно раздувается и принимает форму шара.
Формула давления газа идеального из молекулярно-кинетической теории

При объяснении концепции идеального газа выше были озвучены основные положения молекулярно-кинетической теории (МКТ). Эта теория основывается на статистической механике. Развита она была во второй половине XIX века такими учеными, как Джеймс Максвелл и Людвиг Больцман, хотя ее основы заложил еще Бернулли в первой половине XVIII века.
Согласно статистике Максвелла-Больцмана, все частицы системы движутся с различными скоростями. При этом существует малая доля частиц, скорость которых практически равна нулю, и такая же доля частиц, имеющих огромные скорости. Если вычислить среднюю квадратичную скорость, то она примет некоторую величину, которая в течение времени остается постоянной. Средняя квадратичная скорость частиц однозначно определяет температуру газа.
Применяя приближения МКТ (невзаимодействующие безразмерные и хаотично перемещающиеся частицы), можно получить следующую формулу давления газа в сосуде:
Здесь N – количество частиц в системе, V – объем, v – средняя квадратичная скорость, m – масса одной частицы. Если все указанные величины определены, то, подставив их в единицах СИ в данное равенство, можно рассчитать давление газа в сосуде.
Формула давления из уравнения состояния

В середине 30-х годов XIX века французский инженер Эмиль Клапейрон, обобщая накопленный до него экспериментальный опыт по изучению поведения газов во время разных изопроцессов, получил уравнение, которое в настоящее время называется универсальным уравнением состояния идеального газа. Соответствующая формула имеет вид:
Здесь n – количество вещества в молях, T – температура по абсолютной шкале (в кельвинах). Величина R называется универсальной газовой постоянной, которая была введена в это уравнение русским химиком Д. И. Менделеевым, поэтому записанное выражение также называют законом Клапейрона-Менделеева.
Из уравнения выше легко получить формулу давления газа:
Равенство говорит о том, что давление линейно возрастает с температурой при постоянном объеме и увеличивается по гиперболе с уменьшением объема при постоянной температуре. Эти зависимости отражены в законах Гей-Люссака и Бойля-Мариотта.

Если сравнить это выражение с записанной выше формулой, которая следует из положений МКТ, то можно установить связь между кинетической энергией одной частицы или всей системы и абсолютной температурой.
Давление газа.Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона).Изопроцессы
Давление газа возникает в результате столкновений молекул со стенками сосуда ( и на помещенное в газ тело ), в котором находится беспорядочно движущиеся молекулы газа. Чем чаше удары, тем они сильнее – тем выше давление. Если масса и объем газа неизменны, то его давление в закрытом сосуде всецело зависит от температуры. Давление зависит и от скорости поступательно движущихся газовых молекул. Единица измерения давления — паскаль p(Па). Измеряют давление газа манометром (жидкостным, металлическим и электрическим).
Идеальный газ – это модель реального газа. За идеальный газ принимают газ в сосуде, когда молекула, пролетая от стенки до стенки сосуда не испытывает столкновения с другими молекулами. Точнее, Идеальный газ – это газ, взаимодействие между молекулами которого пренебрежимо мало ⇒ Eк >> Eр .
Основное уравнение МКТ связывает макроскопические параметры (давление p, объём V, температура T, масса m) газовой системы с микроскопическими параметрами (масса молекулы , средняя скорость их движения):
, где n— концентрация, 1/м3; m — масса молекулы, кг; — средняя квадратичная скорость молекул, м/с.
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, объёмом и абсолютной температурой идеального газа, характеризующее состояние данной системы газа. — уравнение Менделеева — Клапейрона (для произвольной массы газа). R = 8,31 Дж/моль·К — универсальная газовая постоянная. pV = RT – (для 1 моля).
Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const). Это означает, что количество вещества ν=const. Тогда:
Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: — уравнение Клапейрона.
Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры. Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов.
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака. Эти законы называют законами для изопроцессов:
Изопроцессы – это процессы, которые совершаются при одинаковом параметре или Т-температуре, или V-объеме, или р-давлении.
Изотермический процесс — — закон Бойля — Мариотта (при постоянной температуре и данной массы газа произведение давления на объем есть величина постоянная)
Изобарный процесс — — закон Гей-Люссака (при постоянном давлении для данной массы газа отношение объема к температуре есть величина постоянная)
Изохорный процесс — — закон Шарля (при постоянном объеме для данной массы газа отношение давления к температуре есть величина постоянная.
Вывели газовые законы из уравнения Менделеева — Клапейрона. Но исторически всё было наоборот: газовые законы были установлены экспериментально, и намного раньше. Уравнение состояния появилось впоследствии как их обобщение.
Давление в газовой смеси

Отвечая на вопрос о том, как найти давление газа и формулы, мы ничего не говорили о том, является ли газ чистым, или речь идет о газовой смеси. В случае формулы для P, которая следует из уравнения Клапейрона, нет никакой связи с химическим составом газа, в случае же выражения для P из МКТ эта связь присутствует (параметр m). Поэтому при использовании последней формулы для смеси газов становится непонятным, какую массу частиц выбирать.
Когда необходимо рассчитать давление смеси идеальных газов, следует поступать одним из двух способов:
- Рассчитывать среднюю массу частиц m или, что предпочтительнее, среднее значение молярной массы M, исходя из атомных процентов каждого газа в смеси;
- Воспользоваться законом Дальтона. Он гласит, что давление в системе равно сумме парциальных давлений всех ее компонентов.
Какой газ используется в жилых домах
Природный газ – понятие условное, которое применяется для горючей газообразной смеси, добываемой из недр, и доставляемой потребителям тепловой энергии в жидком виде.
Состав разнообразен, но всегда преобладает метан (от 80 до 100%). Кроме того, в состав природного газа входят: этан, пропан, бутан, пары воды, водород, сероводород, углекислый газ, азот, гелий. Показателем качества природного газа является количество метана. Все остальные компонентыприродного газа – это неприятные добавки, которые создают загрязняющие выбросы и разрушают трубы. Природный газ для жилых домов, никак не распознаётся органами чувств, поэтому к нему добавляют сильно пахнущие газы – одоронты, выполняющие сигнальную функцию.
Молекулярная физика. Тепловые явления
Решебник к сборнику задач по физике Н. А. Парфентьева
286. Относительная молекулярная масса кислорода равна 32. Отношение масс диоксида углерода С02 и кислорода 02 одинаковых объемов при нормальных условиях (температура 0 С° и давление 1,013 • 105 Па) составляет 11/8. Определите относительную молекулярную массу диоксида углерода.

289. Кольцо массой 10 г изготовлено из сплава золота и серебра. Сколько атомов золота и серебра содержится в этом кольце, если серебра в нем по массе в 4 раза больше, чем золота?

290. Плотность 40%-ного водного раствора соляной кис-лоты 1200 кг/м3. Определите концентрацию молекул НС1 в этом растворе.

294. Спутник сечением 1 м2 движется по околоземной орбите на высоте 200 км. Определите число соударений молекул воздуха со спутником за 1 с. Атмосферное давление на этой высоте 1,37 • 104 Па, а температура 1226 К.

301. Предельное давление газа в неоновой лампе равно 1,5 • 105 Па. Плотность неона в лампе равна 0,9 кг/м3. Определите среднюю квадратичную скорость молекул неона при этом давлении.

304. Молекула массой 10 24 кг движется со средней квадратичной скоростью 400 м/с. Определите изменение концентрации молекул при изменении давления от 105 до 4 • 104 Па.

312. В сосуде находится газ. Как изменится его давление и температура, если средняя скорость молекул увеличится на 30% ?

322. Скорость вращения цилиндров в опыте Штерна 20 рад/с. Расстояние между внутренним и внешним цилиндрами 10 см. Определите смещение полоски серебра при скорости атомов 300 м/с. Радиус внешнего цилиндра 63 см.

329. Азот массой 42 г находится под давлением 2 • 105 Па при температуре 17 °С. После изобарного расширения азот занял объем 40 л. Определите первоначальный объем азота и его конечную температуру.

332. При изотермическом процессе плотность газа изменилась на 0,2 кг/м3, а давление увеличилось на 0,4 атм. Первоначальное давление было равно 1 атм. Вычислите плотность газа в начале процесса.

333. По газопроводу с площадью сечения трубы 5 см2 пропускают углекислый газ со скоростью 0,9 м/с. Определите температуру газа, если его давление 4 атм, а за 10 мин по газопроводу проходит газ массой 2 кг.

337. В цилиндре на пружине подвешен поршень массой 20 кг и площадью поперечного сечения 200 см2. В положении равновесия поршень находится у дна сосуда.
Под поршень закачивают воздух массой 29 г, при этом поршень поднимается на высоту 15 см. Определите жесткость пружины. Эффективная молярная масса воздуха 0,029 кг/моль, температура воздуха 17 °С.

339. Закрытый сосуд заполнен газом при температуре 300 К и давлении 150 кПа. Сосуд снабжен клапаном, открывающимся при давлении 200 кПа. Сосуд нагрели до 600 К. При этом из него вышел газ массой 10 г. Определите массу газа в сосуде до его нагрева.

347. Цилиндрический стакан высотой 10 см, в который налита вода до уровня 6 см, плавает на поверхности воды, причем его края находятся на уровне воды (рис. 78). Из стакана выливают воду и опускают его в сосуд вверх дном, при этом стакан плавает на некоторой глубине. На какой глубине находится дно стакана?

350. Газ перешел из состояния 1 в состояние 2 (рис. 79). Как изменилось давление газа?

361. Давление воздуха внутри бутылки, закрытой пробкой, равно 0,1 МПа при температуре 7 °С. На сколько градусов нужно нагреть воздух в бутылке, чтобы пробка вылетела? Без нагревания пробку можно вынуть, приложив к ней силу 30 Н. Площадь сечения пробки 2 см2.

363. В пятилитровый сосуд, стенки которого рассчитаны на давление 2 МПа, закачали кислород массой 70 г. Выдержат ли стенки, если температура кислорода 300 °с?

372. На рисунке 85 на графике в координатах V — Т показан цикл, совершаемый над идеальным газом. Изобразите этот цикл на графиках в координатах р — V и р — 71.

377. В комнате объемом 200 м3 при температуре 20 °С относительная влажность 50%. Определите массу водяных паров в комнате. Давление насыщенных паров при этой температуре 2,33 кПа.

378. Относительная влажность воздуха при температуре 20 °С равна 70%. Чему будет равна относительная влажность, если воздух нагреть в закрытом помещении до 50 °С? При 20 °С давление насыщенных паров воды 2,33 кПа, при 50 °С давление 12,3 кПа. Чему будет равна относительная влажность, если воздух охладить до 10 °С?
387. Температура воздуха 20 °С, относительная влажность 80%. Определите массу росы, которая выпадет из 1 м3 при понижении температуры воздуха до 12 °С.

398. Определите работу, совершенную идеальным газом количеством вещества 1 моль при переходе из состояния 1 в состояние 4 (рис. 88). Температура в состоянии 1 равна Тг. Отношение р2/рх — 2.
402. На рисунке 90 в координатах р — V изображен цикл, состоящий из двух изохор и двух изобар. Температуры газа в состояниях 1 и 3 равны Тг и Т3. Точки 2 и 4 принадлежат одной изотерме. Определите работу газа за цикл.

409. Два одинаковых железных шарика движутся навстречу друг другу со скоростями 10 и 20 м/с. На сколько повысится температура шариков вследствие неупругого центрального удара, если на нагревание идет половина выделившейся при ударе энергии?

410. Определите массу пара при 100 °С, который надо впустить в сосуд с водой массой 1 кг, находящейся при температуре 20 °С, чтобы температура воды стала равна 80 °С.

419. На кусок льда массой 100 г, находящийся в калориметре при температуре -2 °С, положили железный шарик массой 130 г при температуре 800 °С. Определите температуру, которая установится в калориметре. Удельная теплоемкость железа и льда соответственно равна 450 и 2,1 • 103 Дж/(кг • К).

420. К чайнику с кипящей водой подводится ежесекундно энергия, равная 1,13 кДж. Определите скорость истечения пара из носика чайника, площадь поперечного сечения которого равна 1 см2. Плотность водяного пара 1 кг/м3.

421. На зажженную спиртовку поставили сосуд, в который налита вода массой 500 г при температуре 20 °С. Через какое время выкипит часть воды массой 20 г, если в спиртовке за время 1 мин сгорает 4 г спирта, а КПД спиртовки 60% ? Теплотворная способность спирта 2,93 • 107Дж/кг.

432. Газ переводят из состояния 1 в состояние 2, для чего используют изохорный и изобарный процессы (рис. 93). При этом V2 = 2V19 р2 = 2рг. Определите отношение количеств теплоты, необходимой для совершения перехода из состояния 1 в состояние 2 в одном случае через состояние 3, в другом — через состояние 4. Газ одноатомный.

439. На рисунке 98 изображен график цикла, состоящего из изохоры 1—2, изотермы 2—3 и изобары 3—1. В качестве рабочего вещества используется одно-атомный газ количеством вещества 4 моль. Определите КПД цикла, если известно, что рх = 1 атм, Vx = 1 л, а при изотермическом процессе газ совершает работу 330 Дж.

442. Идеальная тепловая машина имеет температуру нагревателя 400 К, а температуру холодильника 300 К. Определите, какую мощность развивает эта машина, если расход топлива 1(Г3 кг/с, его удельная теплота сгорания 4 • 107 Дж/кг.
Читайте также:

