В четырех цилиндрах без этикеток находятся газы кислород азот оксид углерода 2 оксид углерода 4
Добавил пользователь Евгений Кузнецов Обновлено: 05.10.2024
Углерод
Углерод - неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических веществ в природе.

Общая характеристика элементов IVa группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец - металлы.

- C - 2s 2 2p 2
- Si - 3s 2 3p 2
- Ge - 4s 2 4p 2
- Sn - 5s 2 5p 2
- Pb - 6s 2 6p 2
Природные соединения
- Аллотропных модификаций - графит, алмаз, фуллерен
- MgCO3 - магнезит
- CaCO3 - кальцит (мел, мрамор)
- CaCO3*MgCO3 - доломит

Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз - нагревание без доступа кислорода). Также применяется получение углеродистых соединений: древесины и каменного угля.

Химические свойства
- Реакции с неметаллами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
2С + O2 → (t) 2CO (угарный газ - продукт неполного окисления углерода, образуется при недостатке кислорода)
С + O2 → (t) CO2 (углекислый газ - продукт полного окисления углерода, образуется при достаточном количестве кислорода)
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные степени окисления.
Ca + C → CaC2 (карбид кальция, СО углерода = -1)
Al + C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.

Углерод - хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их оксидов:
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 + C → (t) Si + CO
Может восстановить и собственный оксид:

Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца - крайне важна в промышленности:
В реакциях с кислотами углерод проявляет себя как восстановитель:

Оксид углерода II - СO
Оксид углерода II - продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Растворяясь в крови угарный газ (имеющий в 300 раз большее сродство к гемоглобину, чем кислород) легко выигрывает конкуренцию у кислорода и занимает его место в эритроцитах. Отравление угарным газом нередко заканчивается летальным исходом.
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
FeO + CO → Fe + CO2
Образование карбонилов - чрезвычайно токсичных веществ.

Оксид углерода IV - CO2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ, без запаха.
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
Углекислый газ образуется при горении органических веществ:

Химические свойства
-
Реакция с водой
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние - карбонаты (при избытке основания), кислые - гидрокарбонаты (при избытке кислотного оксида).
2KOH + CO2 → K2CO3 + H2O (соотношение основание - кислотный оксид 2:1)
KOH + CO2 → KHCO3 (соотношение основание - кислотный оксид 1:1)
При нагревании способен окислять металлы до их оксидов.
Zn + CO2 → (t) ZnO + CO

Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.

Химические свойства
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается "закипанием" - появлением пузырьков бесцветного газа без запаха.
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа - помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.

Чтобы сделать из средней соли (карбоната) - кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу H2CO3 - ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 + CO2 + H2O → LiHCO3 (средняя соль + кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты - на карбонат металла, углекислый газ и воду.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Оксид углерода(IV)
Не следует путать с Диоксином.
Плотность при нормальных условиях 1,97 кг/м³. При атмосферном давлении диоксид углерода не существует в жидком состоянии, переходя непосредственно из твёрдого состояния в газообразное. Твёрдый диоксид углерода называют сухим льдом. При повышенном давлении и обычных температурах углекислый газ переходит в жидкость, что используется для его хранения.
Углекислый газ легко пропускает ультрафиолетовые лучи и лучи видимой части спектра, которые поступают на Землю от Солнца и обогревают её. В то же время он поглощает испускаемые Землёй инфракрасные лучи и является одним из парниковых газов, вследствие чего принимает участие в процессе глобального потепления. Постоянный рост уровня содержания этого газа в атмосфере наблюдается с начала индустриальной эпохи.
Содержание
Свойства
Физические
Оксид углерода (IV) – углекислый газ, газ без цвета и запаха, тяжелее воздуха, растворим в воде, при сильном охлаждении кристаллизуется в виде белой снегообразной массы – «сухого льда». При атмосферном давлении он не плавится, а испаряется, температура сублимации -78 °С. Углекислый газ образуется при гниении и горении органических веществ. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Мало растворим в воде (1 объем углекислого газа в одном объеме воды при 15 °С).
Химические
По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом ) и нуклеофильного присоединения (например, с магнийорганическими соединениями).
Биологические
Диоксид углерода играет одну из главных ролей в живой природе, участвуя во многих процессах метаболизма живой клетки. Диоксид углерода получается в результате множества окислительных реакций у животных, и выделяется в атмосферу с дыханием. Углекислый газ атмосферы — основной источник углерода для растений. Однако, ошибкой будет утверждение, что животные только выделяют углекислый газ, а растения — только поглощают его. Растения поглощают углекислый газ в процессе фотосинтеза, а без освещения они тоже его выделяют.
Углекислый газ в организмах животных имеет и физиологическое значение, например, участвует в регуляции сосудистого тонуса (см. Артериолы).
Получение
В промышленных количествах углекислота выделяется из дымовых газов, или как побочный продукт химических процессов, например, при разложении природных карбонатов (известняк, доломит) или при производстве алкоголя. Смесь полученных газов, промывают раствором карбоната калия, которые поглощают углекислый газ, переходя в гидрокарбонат. Раствор гидрокарбоната при нагревании или при пониженном давлении разлагается, высвобождая углекислоту. В современных установках получения углекислого газа вместо гидрокарбоната, чаще применяется водный раствор моноэтаноламина, который при определённых условиях способен абсорбировать СО₂, содержащийся в дымовом газе, а при нагреве отдавать его, таким образом, отделяется готовый продукт от других веществ.
Также углекислый газ получают на установках разделения воздуха, как побочный продукт получения чистого кислорода, азота и аргона.
В лабораторных условиях небольшие количества получают взаимодействием карбонатов и гидрокарбонатов с кислотами, например мрамора, мела или соды с соляной кислотой. Использование реакции серной кислоты с мелом или мрамором приводит к образованию малорастворимого сульфата кальция, который мешает реакции, и который удаляется значительным избытком кислоты.
Для приготовления напитков может быть использована реакция пищевой соды с лимонной кислотой или с кислым лимонным соком. Именно в таком виде появились первые газированные напитки. Их изготовлением и продажей занимались аптекари.
Применение
В пищевой промышленности углекислота используется как консервант и разрыхлитель, обозначается на упаковке кодом Е290.
Жидкая углекислота широко применяется в системах пожаротушения, в огнетушителях и для производства газированной воды и лимонада.
Углекислый газ используется в качестве защитной среды при сварке проволокой, но при высоких температурах происходит его диссоциация с выделением кислорода. Выделяющийся кислород окисляет металл. В связи с этим приходится в сварочную проволоку вводить раскислители, такие как марганец и кремний. Другим следствием влияния кислорода, также связанного с окислением, является резкое снижение поверхностного натяжения, что приводит, среди прочего, к более интенсивному разбрызгиванию металла, чем при сварке в аргоне или гелии.
Когда углекислота применяется в газовой фазе, то для хранения она используется под давлением, как сжиженный газ, в виде жидкой фазы. Хранение углекислоты в баллоне в сжиженном состоянии намного выгоднее, чем в виде газа. Углекислота имеет сравнительно низкую критическую температуру 31°С. Когда в 40-литровый баллон с нормальным давлением 100 кгс/сm² залито 30 кг сжиженного углекислого газа, то при температуре 31°С в баллоне будет только жидкая фаза с давлением 100 кгс/сm². Если температура будет выше, то следует уменьшить заполнение баллона или использовать баллоны с более высоким рабочим давлением. Если углекислота будет охлаждаться, то при температуре 21°С при нормальном заполнении в баллоне появиться газовая фаза.
Твёрдая углекислота — «сухой лёд» — используется в качестве хладагента в лабораторных исследованиях, в розничной торговле и т.д.
Методы регистрации
Углекислый газ в природе
Ежегодные колебания концентрации атмосферной углекислоты на планете определяются, главным образом, растительностью средних (40—70°) широт Северного полушария.
Большое количество углекислоты растворено в океане.
Углекислый газ составляет значительную часть атмосфер некоторых планет Солнечной системы: Венеры, Марса.
Токсичность
У вас будет 45 минут на прохождение диктанта. Отсчёт времени начнётся, как только вы перейдёте по ссылке и подтвердите, что готовы начать диктант. У вас будет 1 попытка.
Диктант содержит 25 вопросов разного уровня сложности. Результаты диктанта вы увидите сразу после его прохождения. Все участники получат именные сертификаты.
Итак, приступим. На нашем сайте мы публикуем задания, а ответы к ним мы находим вместе с вами. Если не согласны с ответом, знаете ответ или увидели ошибку, пишите в комментариях
Химический диктант 2021 ответы

Вопрос 1
В каком случае происходит химическая реакция?
- Разрезание картона
- Горение бумаги
- Разбивание посуды
- Притяжение железа к магниту
Ответ: Горение бумаги
Вопрос 2
В современной периодической таблице – восемнадцать групп элементов (в коротком варианте – восемь), их нумерация начинается с I. А в таблице начала XX века перед I группой стояла особая, нулевая группа. Какие элементы в неё входили?
- Щелочные металлы
- Благородные металлы
- Радиоактивные элементы
- Инертные газы
Ответ: Инертные газы
Вопрос 3
Газообразный водород – очень полезное вещество. Большая его часть расходуется на производство аммиака, но есть и множество других применений. А в какой области он совсем не применяется?
- В пищевой промышленности для производства жиров
- В металлургии для получения металлов
- Для очистки воды
- Для производства энергии
Ответ: Для очистки воды
Вопрос 4
Какой жизненно важный элемент встречается на поверхности Земли исключительно в виде соединений?
- Водород
- Натрий
- Железо
- Углерод
Ответ: Натрий
Вопрос 5
Какая кислота содержится в кефире?
- Соляная
- Кефирная
- Молочная
- Уксусная
Ответ: Молочная
Вопрос 6
Четыре одинаковые ёмкости полностью заполнили водой (1), мелко измельчённой поваренной солью (2), серной кислотой (3) и подсолнечным маслом (4). После этого склянки взвесили. Какая из них имеет наименьшую массу?
- № 1
- № 2
- № 3
- № 4
Ответ: № 4
Вопрос 7
Известно, что озон O3 в верхних слоях атмосферы поглощает жёсткое ультрафиолетовое излучение Солнца (УФ Б) и тем самым защищает от него поверхность Земли. Однако, и сам озон образуется в атмосфере под действием ультрафиолета. Из чего он образуется?
- Кислород
- Вода
- Углекислый газ
- Перекись водорода
Ответ: Углекислый газ
Вопрос 8
Когда водолаз всплывает с большой глубины, внешнее давление резко понижается, и растворённый под давлением в крови газ начинает выделяться в виде пузырьков. Происходит вспенивание крови. Чтобы этого избежать, водолаза сразу помещают в декомпрессионную камеру. Какой газ вызывает такой эффект?
- Озон
- Азот
- Водород
- Хлор
Ответ: Азот
Вопрос 9
Какое вещество НЕ используют в качестве консерванта?
- Поваренную соль
- Бензоат натрия
- Уксусную кислоту
- Нашатырь
Ответ: Нашатырь
Вопрос 10
Если в микроволновой печи взорвалось куриное яйцо, то даже после тщательного мытья останется неприятный запах тухлых яиц, который вызван присутствием сероводорода. Раствором какого вещества лучше всего вымыть печь, чтобы избавиться от запаха?
- Этиловый спирт
- Перекись водорода
- Кальцинированная сода
- Уксусная кислота
Ответ: Уксусная кислота
Вопрос 11
Один из оксидов углерода – углекислый газ CO2 – безвреден для человека, а другой – угарный газ CO – весьма ядовит. Угарный газ образуется при неполном сгорании угля или другого топлива. А какой природный процесс приводит к выделению CO в атмосферу?
- Дыхание человека
- Лесные пожары
- Образование кораллов в морской воде
- Фотосинтез с участием зелёных растений и водорослей
Ответ: Лесные пожары
Вопрос 12
Чтобы улучшить прочностные характеристики каучука, проводят вулканизацию. В этом процессе линейные молекулы каучука сшиваются в единую пространственную сетку. Какое вещество может выступать в качестве вулканизирующего агента?
- Хлорид лития
- Сера
- Этиловый спирт
- Полипропилен
Ответ: Сера
Вопрос 13
Золото, из которого делают ювелирные украшения, представляет собой сплав, а не индивидуальное вещество. Количество золота в сплаве выражают его пробой. Так, в 1000 г золота 916 пробы содержится 916 г золота. Какой химический элемент, кроме золота, содержится в ювелирном сплаве?
- Углерод С
- Кислород О
- Железо Fe
- Медь Cu
Ответ: Медь Cu
Вопрос 14
С каждым годом персональные компьютеры становятся производительнее благодаря уменьшению транзисторов. Чтобы добиться размера в 10 нанометров, нужно получить полупроводниковый материал очень высокой чистоты. Из какого вещества изготавливают процессоры?
- Графит
- Алмаз
- Кремний
- Золото
Ответ: Кремний
Вопрос 15
Соединение свинца – тетраэтилсвинец – в прошлом веке использовали как антидетонационную присадку к топливу. Однако, такой способ повышения октанового числа запретили из-за токсичности свинца. Но родственное металлоорганическое соединение другого легкого элемента нетоксично и до сих пор используется как катализатор в производстве полиэтилена. Назовите этот элемент.
- Алюминий
- Ртуть
- Железо
- Сера
Ответ: Алюминий
Вопрос 16
Самые летучие углеводороды (с наиболее низкими температурами кипения) входят в состав
- Горючей смеси для зажигалок
- Авиационного керосина
- Мазута
- Асфальта
Ответ: Авиационного керосина
Вопрос 17
Кровь человека окрашена в красный цвет из-за присутствия в ней железосодержащего пигмента гемоглобина, способного обратимо связываться с кислородом воздуха. В природе встречаются животные, чья кровь имеет голубой цвет, например, моллюски. Такой необычный цвет их крови вызван присутствием в ней аналога гемоглобина — гемоцианина, содержащего в своем активном центре не железо, а
- Кальций
- Медь
- Уран
- Цезий
Ответ: Медь
Вопрос 18
Яркая окраска фейерверков связана с электронными переходами в атомах металлов, соединения которых вводят в состав пиротехнических смесей. Жёлтую окраску фейерверку придают атомы
- Натрия
- Калия
- Кальция
- Меди
Ответ: Натрий .
Вопрос 19
Минерал флюорит CaF2 представляет собой соль
- Уксусной кислоты
- Серной кислоты
- Азотной кислоты
- Плавиковой кислоты
Ответ: Плавиковой кислоты
Вопрос 20
Выдающийся физик Нильс Бор за создание теории строения атома в 1922 году был награжден Нобелевской золотой медалью. Во время Второй мировой войны, когда немцы оккупировали Данию, он уничтожил медаль, чтобы она не досталась врагу. Каким способом он это сделал?
- Расплавил
- Растёр в порошок
- Растворил в «царской водке»
- Сжёг
Ответ: Растворил в «царской водке»
Вопрос 21
Что общего между молекулами метана CH4, аммиака NH3 и воды H2O?
- Число атомов в молекуле
- Молекулярная масса
- Число электронов в молекуле
- Число химических связей в молекуле
Ответ: Число электронов в молекуле
Вопрос 22
Изделие из этого материала невозможно соединить дуговой сваркой, производимой на воздухе. Назовите материал.
- Чугун
- Сталь
- Дюраль (дуралюмин)
- Бронза
Ответ: Дюраль (дуралюмин)
Вопрос 23
Для обеспечения жизнедеятельности человека в замкнутых экосистемах ограниченного объёма, таких как подводные лодки или космические корабли, необходимо решить проблемы регенерации воды и воздуха. Какое вещество можно использовать для регенерации воздуха?
- CaO
- KO2
- NaHCO3
- LiOH
Ответ: KO2
Вопрос 24
Французский дизайнер Эмиль Галле стал использовать химическое травление многослойного стекла для создания художественных изделий. С этой целью он наносил на стекло раствор, содержащий
- Плавиковую кислоту
- Хлорид натрия
- Соляную кислоту
- Ацетон
Ответ: Плавиковую кислоту
Вопрос 25
Свинцовые художественные белила известны человечеству ещё со времен античности и высоко ценятся за свою кроющую способность. Однако из-за высокой токсичности сейчас они почти полностью вытеснены белилами на основе диоксида титана TiO2. Ещё один недостаток свинцовых белил состоит в том, что со временем они чернеют из-за присутствия в воздухе сероводорода, который превращает белила в устойчивый сульфид свинца PbS. Какое вещество используют для реставрации картин с такими красками?
Углерод. Химия углерода и его соединений

Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
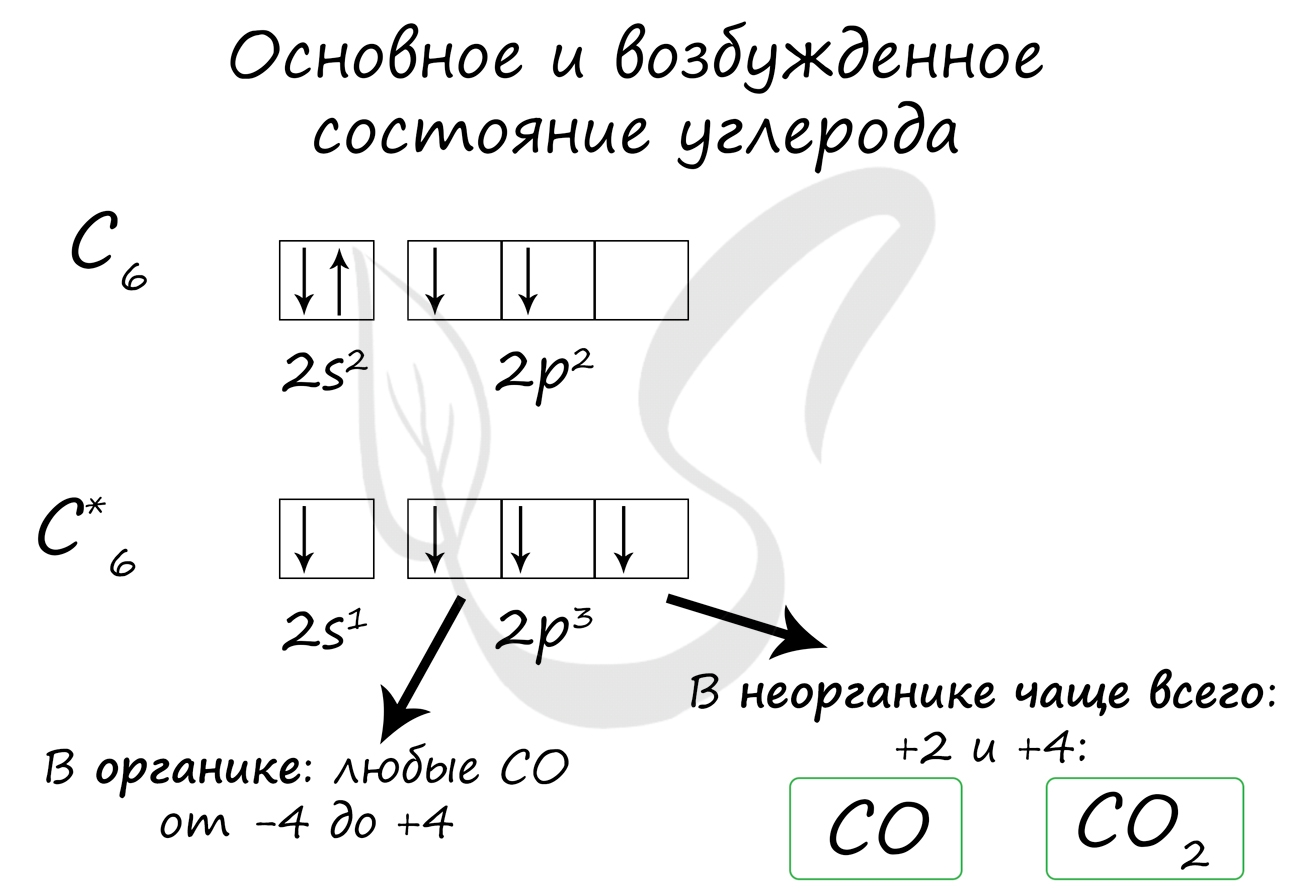
Электронная конфигурация углерода в основном состоянии :
+6С 1s 2 2s 2 2p 2 1s 2s 2p
Электронная конфигурация углерода в возбужденном состоянии :
+6С * 1s 2 2s 1 2p 3 1s 2s 2p
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.




[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n



Качественные реакции
Например , карбонат кальция растворяется в соляной кислоте:
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:

Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Углекислый газ СО2 не поддерживает горение . Угарный газ CO горит голубым пламенем.
Соединения углерода
Наиболее типичные соединения углерода:
карбиды металлов (карбид алюминия Al4C3)
Химические свойства
1. Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами , и с неметаллами .
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
1.3. Углерод не взаимодействует с фосфором .
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
2C + Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит , образуя оксид углерода (IV):
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:

Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C 0 + H2 + O → C +2 O + H2 0
2.2. Углерод восстанавливает многие металлы из основных и амфотерных оксидов . При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например , углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например , углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует в данной реакции:
3С + СаО → СаС2 + СО
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями , в которых содержатся неметаллы с высокой степенью окисления.
Например , углерод восстанавливает сульфат натрия до сульфида натрия:
Карбиды
Карбиды – это соединения элементов с углеродом . Карбиды разделяют на ковалентные и ионные в зависимости от типа химической связи между атомами.
Например :
Например :
Например :
Это соединения с металлами, при гидролизе которых образуется пропин
Например : Mg2C3
Например :
Например:
СаС2+ 2Н2O →
Пропиниды разлагаются водой или кислотами с образованием пропина и гидроксида или соли
Например:
Все карбиды проявляют свойства восстановителей и могут быть окислены сильными окислителями .
Например , карбид кремния окисляется концентрированной азотной кислотой при нагревании до углекислого газа, оксида кремния (IV) и оксида азота (II):
SiC + 8HNO3 → 3SiO2 + 3CO2 + 8NO + 4H2O
Оксид углерода (II)
Строение молекулы и физические свойства
Строение молекулы оксида углерода (II) – линейное. Между атомами углерода и кислорода образуется тройная связь, за счет дополнительной донорно-акцепторной связи:

Способы получения
В лаборатории угарный газ можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоты:
НСООН → CO + H2O
В промышленности угарный газ получают в газогенераторах при пропускании воздуха через раскаленный уголь:
CO2 + C → 2CO
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Угарный газ в промышленности также можно получать неполным окислением метана:
Химические свойства
Оксид углерода (II) – несолеобразующий оксид . За счет углерода со степенью окисления +2 проявляет восстановительные свойства.
1. Угарный газ горит в атмосфере кислорода . Пламя окрашено в синий цвет:
2. Оксид углерода (II) окисляется хлором в присутствии катализатора или под действием света с образованием фосгена. Фосген – ядовитый газ.
3. Угарный газ взаимодействует с водородом при повышенном давлении . Смесь угарного газа и водорода называется синтез-газ. В зависимости от условий из синтез-газа можно получить метанол, метан, или другие углеводороды.
Например , под давлением больше 20 атмосфер, при температуре 350°C и под действием катализатора угарный газ реагирует с водородом с образованием метанола:
4. Под давлением оксид углерода (II) реагирует с щелочами. При этом образуется формиат – соль муравьиной кислоты.
Например , угарный газ реагирует с гидроксидом натрия с образованием формиата натрия:
CO + NaOH → HCOONa
5. Оксид углерода (II) восстанавливает металлы из оксидов .
Например , оксид углерода (II) реагирует с оксидом железа (III) с образованием железа и углекислого газа:
Оксиды меди (II) и никеля (II) также восстанавливаются угарным газом:
СО + CuO → Cu + CO2
СО + NiO → Ni + CO2
6. Угарный газ окисляется и другими сильными окислителями до углекислого газа или карбонатов.
Например , пероксидом натрия:
Оксид углерода (IV)
Строение молекулы и физические свойства
Смешивая сухой лед и различные вещества, можно получить интересные эффекты. Например, сухой лед в пиве:
Углекислый газ не горит, поэтому его применяют при пожаротушении.
Молекула углекислого газа линейная , атом углерода находится в состоянии sp-гибридизации, образует две двойных связи с атомами кислорода:

Обратите внимание! Молекула углекислого газа не полярна. Каждая химическая связь С=О по отдельности полярна, а вся молекула не будет полярна. Объяснить это очень легко. Обозначим направление смещения электронной плотности в полярных связях стрелочками (векторами):

Способы получения
В лаборатории углекислый газ можно получить разными способами:
1. Углекислый газ образуется при действии сильных кислот на карбонаты и гидрокарбонаты металлов. При этом взаимодействуют с кислотами и нерастворимые карбонаты, и растворимые.
Например , карбонат кальция растворяется в соляной кислоте:
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Еще один пример : гидрокарбонат натрия реагирует с бромоводородной кислотой:
2. Растворимые карбонаты реагируют с растворимыми солями алюминия, железа (III) и хрома (III) . Карбонаты трехвалентных металлов необратимо гидролизуются в водном растворе.
Например: хлорид алюминия реагирует с карбонатом калия. При этом выпадает осадок гидроксида алюминия, выделяется углекислый газ и образуется хлорид калия:
3. Углекислый газ также образуется при термическом разложении нерастворимых карбонатов и при разложении растворимых гидрокарбонатов.
Например , карбонат кальция разлагается при нагревании на оксид кальция и углекислый газ:
Химические свойства
1. Как кислотный оксид, углекислый газ взаимодействует с водой . Реакция очень сильно обратима, поэтому мы считаем, что в реакциях угольная кислота распадается почти полностью при образовании.
2. Как кислотный оксид, углекислый газ взаимодействует с основными оксидами и основаниями . При этом углекислый газ реагирует только с сильными основаниями (щелочами) и их оксидами . При взаимодействии углекислого газа с щелочами возможно образование как кислых, так и средних солей.
Например , гидроксид калия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат калия:
При избытке щелочи образуется средняя соль, карбонат калия:
Видеоопыт взаимодействия гидроксида кальция (известковая вода) с углекислым газом можно посмотреть здесь.
3. Углекислый газ взаимодействует с карбонатами . При пропускании СО2 через раствор карбонатов образуются гидрокарбонаты.
Например , карбонат натрия взаимодействует с углекислым газом. В избытке углекислого газа образуется кислая соль, гидрокарбонат натрия:
4. Как слабый окислитель, углекислый газ взаимодействует с некоторыми восстановителями .
Например , углекислый газ взаимодействует с углеродом с образованием угарного газа:
CO2 + C → 2CO
Магний горит в атмосфере углекислого газа:
2М g + CO 2 → C + 2 MgO
Видеоопыт взаимодействия магния с углекислым газом можно посмотреть здесь.
Поэтому углекислый газ нельзя применять для пожаротушения горящего магния.
Углекислый газ взаимодействует с пероксидом натрия. При этом пероксид натрия диспропорционирует:
Карбонаты и гидрокарбонаты
При нагревании карбонаты (все, кроме карбонатов щелочных металлов и аммония) разлагаются до оксида металла и оксида углерода (IV).
Карбонат аммония при нагревании разлагается на аммиак, воду и углекислый газ:
Гидрокарбонаты при нагревании переходят в карбонаты:
Качественной реакцией на ионы СО3 2─ и НСО3 − является их взаимодействие с более сильными кислотами , последние вытесняют угольную кислоту из солей, а та разлагается с выделением СО2.
Например , карбонат натрия взаимодействует с соляной кислотой:
Гидрокарбонат натрия также взаимодействует с соляной кислотой:
NaHCO3 + HCl → NaCl + CO2 ↑ + H2O
Гидролиз карбонатов и гидрокарбонатов
Растворимые карбонаты и гидрокарбонаты гидролизуются по аниону. Гидролиз протекает ступенчато и обратимо, т.е. чуть-чуть:
Однако карбонаты и гидрокарбонаты алюминия, хрома (III) и железа (III) гидролизуются необратимо, полностью, т.е. в водном растворе не существуют, а разлагаются водой:
В четырех цилиндрах без этикеток находятся газы кислород азот оксид углерода 2 оксид углерода 4
Урок посвящен изучению свойств и способов получения некоторых неорганических соединений углерода. В нем рассмотрены такие вещества, как оксид углерода (II) (или угарный газ), оксид углерода (IV) (или углекислый газ), угольная кислота, а также карбонаты и гидрокарбонаты.
I. Оксид углерода(II) – СО (угарный газ, окись углерода, монооксид углерода)
Физические свойства:
Бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода +2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах):
CO2 + C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
смесь СО + Н2 – называется синтез – газом.
2) В лаборатории - термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO - несолеобразующий оксид.
1) Взаимодействие с кислородом: 2C +2 O + O2 t ˚ C → 2C +4 O2↑
2) Взаимодействие с оксидами металлов: CO + MexOy = CO2 + Me
C +2 O + CuO t ˚ C → Сu + C +4 O2↑
3) Взаимодействие с хлором (на свету)
CO + Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* Взаимодействие с расплавами щелочей (под давлением)
CO + NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
II. Оксид углерода (IV) СO2 – углекислый газ
Учебный видео-фильм: “Углекислый газ”
Физические свойства:
Углекислый газ, бесцветный, без запаха, растворимость в воде - в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется "сухой лёд"); не поддерживает горение. При обычной температуре и высоком давлении диоксид углерода сжижается. При его испарении поглощается так много теплоты, что часть оксида углерода (IV)превращается в снегообразную массу – «сухой лед» (Рис. 1).
Рис. 1. Сухой лед
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
Строение молекулы:
Углекислый газ имеет следующие электронную и структурную формулы - O=C=O
Все четыре связи ковалентые полярные.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
Способы собирания: вытеснением воздуха
3. Сгорание углеродсодержащих веществ:
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства:
1) С водой даёт непрочную угольную кислоту:
2)Рреагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
3) При повышенной температуре может проявлять окислительные свойства – окисляет металлы: -СO2 + Me = MexOy + C
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
III. Угольная кислота и её соли
Химическая формула - H2CO3
Структурная формула – все связи ковалентные полярные:
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор - лакмус краснеет в водном растворе:
2) с активными металлами
3) с основными оксидами
4) с основаниями
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
- Средние соли - карбонаты Na2СO3, (NH4)2CO3
- Кислые соли - бикарбонаты, гидрокарбонаты NaHCO3 , Ca(HCO3)2
В природе встречаются:
CaCO3
Мел Мрамор Известняк
NaHCO3 – питьевая сода
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
2) Разложение гидрокарбонатов при нагревании
3) Разложение нерастворимых карбонатов при нагревании
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Специфические свойства:
1) Качественная реакция на CO 3 2- карбонат – ион "вскипание" при действии сильной кислоты:
IV. Задания для закрепления
Задание №1. Закончите уравнения реакций, составьте электронный баланс для каждой из реакций, укажите процессы окисления и восстановления; окислитель и восстановитель:
Задание №2. Вычислите количество энергии, которое необходимо для получения 448 л угарного газа согласно термохимическому уравнению
CO2 + C = 2CO – 175 кДж
Задание №3. Закончите уравнения осуществимых химических реакций:
Углекислый и угарный газы
- углекислый газ (оксид углерода(IV) - CO2) образуются при горении угля, дыхании, гниении и т.д.

- имеет кисловатый запах и вкус;
- является кислотным оксидом;
- не поддерживает горение и не горит сам, поэтому используется в огнетушителях;
- лучше растворяется в воде, чем кислород. При повышенном давлении растворимость увеличивается, что и используют при изготовлении газированных напитков. Однако, когда крышка с напитком открывается, давление становится равным атмосферному, растворимость газа снижается и жидкость словно закипает, выделяя лишний углекислый газ с характерным звуком;
- при низкой температуре и сильном давлении превращается в «сухой лед», который схож с обычным снегом и льдом. Обычно используется для перевозки мороженого;
- в лаборатории, для получения углекислого газа, используют аппарат Киппа, смешивая мрамор (CaCO3) с соляной кислотой;
- в промышленности получают при температуре в 1000 °C, разлагая известняк;
- используется для производства соды, газировки, огнетушителей и т.д.;
- так как содержание углекислого газа возрастает в составе атмосферы планеты, то молекулы газа все больше и больше задерживают тепло, не выпуская его излишки в открытый космос. Что неумолимо ведет нас всех к глобальному потеплению;
- углекислый газ накапливается в низинах, а также в закрытых помещениях, поэтому так важно проветривать закрытые помещения с большим количеством людей. Ведь даже 4% углекислого газа в воздухе хватает, чтобы возникла головная боль, участился пульс и повысилось кровяное давление;
Угарный газ
- угарный газ (оксид углерода(II) - CO) еще опаснее, так как вызывает отравление даже со смертельным исходом. Признаки отравления: головная боль, тошнота, головокружение, возможна потеря сознания. Первая помощь: вынести человека на свежий воздух, сделать искусственное дыхание;

- образуется при горении наряду с углекислым газом (при неполном сгорании угля из-за недостатка кислорода) или при взаимодействии угля и углекислого газа. При зажигании спички, синяя кайма пламени в нижней части это пламя угарного газа;
- бесцветный, без вкуса и запаха, почти нерастворим в воде;
- в противогазах есть специальный катализатор, который окисляет угарный газ до углекислого;
- угарный газ восстанавливает металлы из оксидов, как и уголь.
Редактировать этот урок и/или добавить задание Добавить свой урок и/или задание
Добавить интересную новость
Добавить анкету репетитора и получать бесплатно заявки на обучение от учеников
user->isGuest) < echo (Html::a('Войдите', ['/user/security/login'], ['class' =>'']) . ' или ' . Html::a('зарегистрируйтесь', ['/user/registration/register'], ['class' => '']) . ' , чтобы получать деньги $$$ за каждый набранный балл!'); > else < if(!empty(\Yii::$app->user->identity->profile->first_name) || !empty(\Yii::$app->user->identity->profile->surname))< $name = \Yii::$app->user->identity->profile->first_name . ' ' . \Yii::$app->user->identity->profile->surname; > else < $name = ''; >echo 'Получайте деньги за каждый набранный балл!'; > ?>-->
При правильном ответе Вы получите 1 балл
Какой газ опаснее для человека?
Выберите всего один правильный ответ.
Lorem iorLorem ipsum dolor sit amet, sed do eiusmod tempbore et dolore maLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborgna aliquoLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempbore et dLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborlore m mollit anim id est laborum.
28.01.17 / 22:14, Иван Иванович Ответить +5
Lorem ipsum dolor sit amet, consectetu sed do eiusmod qui officia deserunt mollit anim id est laborum.
28.01.17 / 22:14, Иван ИвановичОтветить -2
Lorem ipsum dolor sit amet, consectetur adipisicing sed do eiusmod tempboLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod temLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborpborrum.
Читайте также:

