Где в митохондриях происходит синтез атф в крестах
Добавил пользователь Евгений Кузнецов Обновлено: 04.10.2024
Ресинтез АТФ в мышечных волокнах
Дано определение ресинтеза АТФ. Описаны основные пути ресинтеза АТФ в мышечных волокнах: креатинфосфатный, гликолитический, миокиназный и тканевое дыхание. Описаны количественные критерии путей ресинтеза АТФ, соотношение между различными путями ресинтеза АТФ при мышечной работе, а также между путями ресинтеза АТФ и зонами относительной мощности.
Ресинтез АТФ в мышечных волокнах
Определение
Ресинтез АТФ – синтез АТФ из различных энергетических субстратов во время физической работы в мышечных волокнах.
Формула ресинтеза АТФ выглядит следующим образом:
Пути ресинтеза АТФ
Ресинтез АТФ может осуществляться двумя путями:
- с участием кислорода (аэробный путь).
- без участия кислорода (анаэробный путь);
Аэробный путь (тканевое дыхание, аэробное или окислительное фосфорилирование) – основной способ образования АТФ в мышечных волокнах. Он протекает в митохондриях мышечных волокон. В результате тканевого дыхания выделяется 39 молекул АТФ. Окисляемое вещество распадается до углекислого газа и воды.
Анаэробный ресинтез АТФ
Анаэробные пути ресинтеза АТФ являются дополнительными способами образования АТФ в мышечных волокнах в тех случаях, когда основной путь получения АТФ – тканевое дыхание не может обеспечить мышечную деятельность необходимым количество кислорода. Эти механизмы ресинтеза АТФ активно функционируют в начале выполнения физических упражнений, когда тканевое дыхание не полностью «развернулось», а также при физических нагрузках высокой мощности.
Анаэробный ресинтез АТФ в мышечных волокнах возможен посредством нескольких механизмов:
-
– ресинтез АТФ из креатинфосфата; – ресинтез АТФ из гликогена мышц;
- Миокиназный (аденилаткиназный) ресинтез АТФ – ресинтез АТФ из АДФ при значительном накоплении в мышечных волокнах АДФ. Рассматривается как аварийный механизм, обеспечивающий ресинтез АТФ, когда другие пути ресинтеза АТФ невозможны.
Количественные критерии путей ресинтеза АТФ
Существуют количественные критерии путей ресинтеза АТФ. К ним можно отнести: максимальную мощность, время развертывания, время сохранения или поддержания максимальной мощности, метаболическую ёмкость (табл. 1).
- Максимальная мощность – максимальное количество АТФ, которое может образоваться в единицу времени при функционировании данного пути ресинтеза АТФ.
- Время развертывания – минимальная длительность, необходимая для выхода ресинтеза АТФ на свою максимальную мощность.
- Время сохранения или поддержания максимальной скорости – длительность функционирования данного пути ресинтеза АТФ с максимальной мощностью.
- Метаболическая ёмкость – количество АТФ, которое может образоваться во время мышечной работы за счёт данного пути ресинтеза АТФ.
Таблица 1. Количественные критерии основных путей ресинтеза АТФ (С.С. Михайлов, 2009)
Соотношение между различными путями ресинтеза АТФ
При любой мышечной работе функционируют все три основных механизма ресинтеза АТФ, но включаются они последовательно. В первые секунды ресинтез АТФ осуществляется за счет креатинфосфатной реакции, затем включается гликолиз. По мере продолжения работы на смену гликолизу приходит тканевое дыхание (рис.1). Эта смена механизмов ресинтеза АТФ приводит к уменьшению суммарной выработки АТФ.
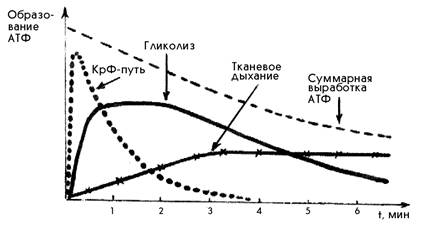
Рис.1. Включение путей ресинтеза АТФ при выполнении физической работы (С.С. Михайлов, 2009)
Пути ресинтеза АТФ и зоны относительной мощности
В.С. Фарфель приводит следующее соотношение мощности работы и основной системы энергообеспечения (табл.2)
Таблица 2. Зоны мощности работы и основная система энергообеспечения (В.С. Фарфель)
Синтез АТФ в клетке
Аденозинтрифосфорная кислота-АТФ - обязательный энергетический компонент любой живой клетки. АТФ также нуклеотид, состоящий из азотистого основания аденина, сахара рибозы и трех остатков молекулы фосфорной кислоты. Это неустойчивая структура. В обменных процессах от нее последовательно отщепляются остатки фосфорной кислоты путем разрыва богатой энергией, но непрочной связи между вторым и третьим остатками фосфорной кислоты. Отрыв одной молекулы фосфорной кислоты сопровождается выделением около 40 кДж энергии. В этом случае АТФ переходит в аденозиндифосфорную кислоту (АДФ), а при дальнейшем отщеплении остатка фосфорной кислоты от АДФ образуется аденозинмонофосфорная кислота (АМФ).
Схема строения АТФ и превращения ее в АДФ (Т.А. Козлова, В.С. Кучменко. Биология в таблицах. М.,2000)
АДФ
Следовательно, АТФ - своеобразный аккумулятор энергии в клетке, который "разряжается" при ее расщеплении. Распад АТФ происходит в процессе реакций синтеза белков, жиров, углеводов и любых других жизненных функций клеток. Эти реакции идут с поглощением энергии, которая извлекается в ходе расщепления веществ.
АТФ синтезируется в митохондриях в несколько этапов. Первый из них - подготовительный - протекает ступенчато, с вовлечением на каждой ступени специфических ферментов. При этом сложные органические соединения расщепляются до мономеров: белки - до аминокислот, углеводы - до глюкозы, нуклеиновые кислоты - до нуклеотидов и т. д. Разрыв связей в этих веществах сопровождается выделением небольшого количества энергии. Образовавшиеся мономеры под действием других ферментов могут претерпеть дальнейший распад с образованием более простых веществ вплоть до диоксида углерода и воды.
Схема Синтез АТФ в мвтохондрии клетки
ПОЯСНЕНИЯ К СХЕМЕ ПРЕВРАЩЕНИЕ ВЕЩЕСТВ И ЭНЕРГИИ В ПРОЦЕССЕ ДИССИМИЛЯЦИИ
I этап - подготовительный: сложные органические вещества под действием пищеварительных ферментов распадаются на простые, при этом выделяется только тепловая энергия.
Белки ->аминокислоты
Жиры-> глицерин и жирные кислоты
Крахмал -> глюкоза
II этап-гликолиз (бескислородный): осуществляется в гиалоплазме, с мембранами не связан; в нем участвуют ферменты; расщеплению подвергается глюкоза:
У дрожжевых грибов молекула глюкозы без участия кислорода превращается в этиловый спирт и диоксид углерода (спиртовое брожение):
У других микроорганизмов гликолиз может завершаться образованием ацетона, уксусной кислоты и т, д. Во всех случаях распад одной молекулы глюкозы сопровождается образованием двух молекул АТФ. В ходе бескислородного расщепления глюкозы в виде химической связи в молекуле АТФ сохраняется 40% анергии, а остальная рассеивается в виде теплоты.
III этап-гидролиз (кислородный): осуществляется в митохондриях, связан с матриксом митохондрий и внутренней мембраной, в нем участвуют ферменты, расщеплению подвергается молочная кислота: СзН6Оз+ЗН20 -->3СО2+ 12Н. С02 (диоксид углерода) выделяется из митохондрий в окружающую среду. Атом водорода включается в цепь реакций, конечный результат которых - синтез АТФ. Эти реакции идут в такой последовательности:
1. Атом водорода Н с помощью ферментов-переносчиков поступает во внутреннюю мембрану митохондрий, образующую кристы, где он окисляется: Н-е-->H+
2. Протон водорода H+ (катион) выносится переносчиками на наружную поверхность мембраны крист. Для протонов эта мембрана непроницаема, поэтому они накапливаются в межмембранном пространстве, образуя протонный резервуар.
3. Электроны водорода e переносятся на внутреннюю поверхность мембраны крист и тут же присоединяются к кислороду с помощью фермента оксидазы, образуя отрицательно заряженный активный кислород (анион): O2 + е-->O2-
4. Катионы и анионы по обе стороны мембраны создают разноименно заряженное электрическое поле, и когда разность потенциалов достигнет 200 мВ, начинает действовать протонный канал. Он возникает в молекулах ферментов АТФ-синтетаз, которые встроены во внутреннюю мембрану, образующую кристы.
5. Через протонный канал протоны водородаH+ устремляются внутрь митохондрий, создавая высокий уровень энергии, большая часть которой идет на синтез АТФ из АДФ и Ф (АДФ+Ф-->АТФ), а протоны H+ взаимодействуют с активным кислородом, образуя воду и молекулярный 02:
( 4Н++202- -->2Н20+02)
Таким образом, О2, поступающий в митохондрии в процессе дыхания организма, необходим для присоединения протонов водорода Н. При его отсутствии весь процесс в митохондриях прекращается, так как электронно-транспортная цепь перестает функционировать. Общая реакция III этапа:
(2СзНбОз + 6Oз + 36АДФ + 36Ф ---> 6С02 + 36АТФ + +42Н20)
В результате расщепления одной молекулы глюкозы образуются 38 молекул АТФ: на II этапе - 2 АТФ и на III этапе - 36 АТФ. Образовавшиеся молекулы АТФ выходят за пределы митохондрии и участвуют во всех процессах клетки, где необходима энергия. Расщепляясь, АТФ отдает энергию (одна фосфатная связь заключает 40 кДж) и в виде АДФ и Ф (фосфата) возвращается в митохондрии.
Где в митохондриях происходит синтез атф в крестах
Организация клетки. Митохондрии
Митохондрии: структура и функции
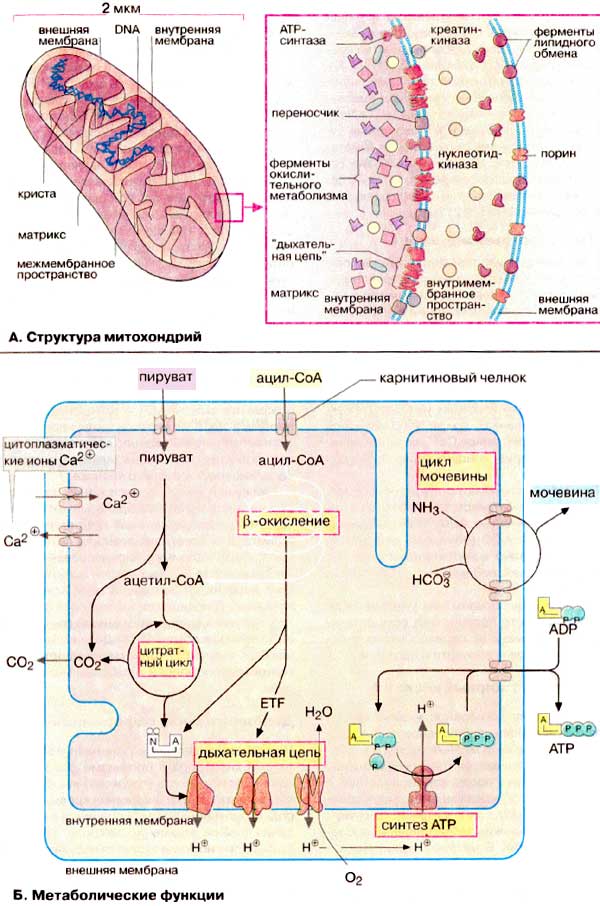
А. Структура митохондрий
Митохондрии - это органеллы размером с бактерию (около 1 х 2 мкм). Они найдены в большом количестве почти во всех эукариотических клетках. Обычно в клетке содержится около 2000 митохондрий, общий объем которых составляет до 25% от общего объема клетки. Митохондрия ограничена двумя мембранами - гладкой внешней и складчатой внутренней , имеющей очень большую поверхность. Складки внутренней мембраны глубоко входят в матрикс митохондрий, образуя поперечный перегородки - кристы . Пространство между внешней и внутренней мембранами обычно называют межмембранным пространством .
Различный типы клеток отличаются друг от друга как по количеству и форме митохондрий, так и по количеству крист. Особенно много крист имеют митохондрии в тканях с активными окислительными процессами, например в сердечной мышце. Вариации митохондрий по форме, что зависит от их функционального состояния, могут наблюдаться и в тканях одного типа. Митохондрии — изменчивые и пластичные органеллы.
Мембраны митохондрий содержат интегральные мембранные белки. Во внешнюю мембрану входят порины , которые образуют поры и делают мембраны проницаемыми для веществ с молекулярной массой до 10 кДа (см. рис. 223). Внутренняя же мембрана митохондрий непроницаема для большинства молекул; исключение составляют О 2 , СО 2 , Н 2 0. Внутренняя мембрана митохондрий характеризуется необычно высоким содержанием белков (75%). В их число входят транспортные белки-переносчики (см. рис. 215), ферменты, компоненты дыхательной цепи и АТФ-синтаза . Кроме того, в ней содержится необычный фосфолипид кардиолипин (см. с. 56). Матрикс также обогащен белками, особенно ферментами цитратного цикла.
Б. Метаболические функции
Главной функцией митохондрий является захват богатых энергией субстратов (жирные кислоты, пируват, углеродный скелет аминокислот) из цитоплазмы и их окислительное расщепление с образованием СО 2 и Н 2 О, сопряженное с синтезом АТФ.
Реакции цитратного цикла приводят к полному окислению углеродсодержащих соединений (СО 2 ) и образованию восстановительных эквивалентов, главным образом в виде восстановленных коферментов. Большинство этих процессов протекают в матриксе. Ферменты дыхательной цепи , которые реокисляют восстановленные коферменты, локализованы во внутренней мембране митохондрий. В качестве доноров электронов для восстановления кислорода и образования воды используются НАДН и связанный с ферментом ФАДН 2 . Эта высоко экзергоническая реакция является многоступенчатой и сопряжена с переносом протонов (Н + ) через внутреннюю мембрану из матрикса в межмембранное пространство (см. рис. 143). В результате на внутренней мембране создается электрохимический градиент (см. рис. 129). В митохондриях электрохимический градиент используется для синтеза АТФ из АДФ (ADP) и неорганического фосфата (Р i ) при катализе АТФ-синтазой . Электрохимический градиент является также движущей силой ряда транспортных систем (см. рис. 215).
Цепи в клетке: данные об устройстве митохондрий помогут лечить сердце
Ученые из НИЦ «Курчатовский институт» и МГУ им. М.В. Ломоносова при помощи суперсовременного микроскопа заглянули внутрь живой клетки и увидели, как происходит процесс передачи энергии в митохондриях. Фундаментальное открытие позволит в будущем создавать лекарства против болезней, которые связаны с нарушениями энергообмена в клетках. В их число входят, например, инсульты и ишемическая болезнь сердца, нейродегенеративные заболевания. Другое возможное практическое применение новых знаний — создание природоподобных электрических устройств, работающих на протонном токе, например биосовместимых искусственных имплантатов.
Энергичное дыхание

Научные сотрудники НИЦ «Курчатовский институт» получили новые данные об универсальном механизме передачи энергии в клетках. Они выяснили, с помощью каких структур происходит перенос протонов через мембрану митохондрий в процессе клеточного дыхания. С помощью криоэлектронного микроскопа ученым удалось заглянуть внутрь клетки и рассмотреть, как в митохондриях расположены белки, образующие дыхательную цепь. Белки этой цепи используют энергию превращения кислорода в воду для синтеза аденозинтрифосфата (АТФ) — так называемой универсальной «энергетической валюты», которая вовлечена в работу всех энергозависимых клеточных систем.
— Процессы переноса и преобразования энергии в живых организмах должны быть оптимально организованы. Для выяснения максимально эффективных природных механизмов преобразования энергии, тщательно отобранных миллионами лет эволюции, нами и была проделана эта работа, — рассказал научный сотрудник комплекса НБИКС-природоподобных технологий НИЦ «Курчатовский институт» Семен Нестеров.

Уже более полувека в научном мире продолжается дискуссия о том, как именно происходит трансформация энергии в клетках. Одна из гипотез — хемиосмотическая — утверждает, что она накапливается в разности концентраций ионов водорода по разные стороны митохондриальной мембраны. Сторонники другой — модели локального сопряжения — склоняются к мысли, что ионы водорода передаются по самой мембране.

Благодаря современному криоэлектронному микроскопу ученые Курчатовского института обнаружили расположение белков относительно друг друга, которое создает оптимальные условия для направленной локальной передачи энергии в форме ионов водорода по поверхности мембраны. Оказалось, что протоны переносятся по ней между ферментами на расстояние 5–10 нанометров. Открытие подтверждает состоятельность модели локального сопряжения, но не исключает, что хемиосмотическая теория в каких-то условиях также может быть верна.
Результаты исследования открывают новые возможности в борьбе с болезнями, при которых происходят нарушения в работе митохондрий. К ним относятся нейродегенеративные болезни Альцгеймера и Паркинсона, а также ишемическая болезнь сердца и различные виды инсультов. Другое возможное практическое применение новых знаний — создание природоподобных электрических устройств, работающих на протонном токе. Это могут быть, например, биосовместимые искусственные имплантаты.
Круговорот протонов
Митохондрии снабжают организм энергией и делают это в два этапа. На первом этапе они сжигают питательные вещества в кислороде и откачивают положительно заряженные частицы наружу, а на втором — протоны возвращаются внутрь митохондрий и происходит синтез молекулы АТФ — источника энергии, пояснил ведущий научный сотрудник МГУ им. М.В. Ломоносова и гендиректор компании «Митотех» Максим Скулачёв. За эти процессы отвечают две разные системы, но из общефизических соображений было бы разумно расположить источник энергии и потребителя энергии в одном месте, образовав единый суперкомплекс, добавил он. Ученые уже долгое время строили гипотезы о существовании такого суперкомплекса, и теперь они подтвердились, подчеркнул эксперт.
Синтез АТФ

Молекулы АТФ жизненно необходимы. АТФ служит источником энергии, необходимой для сокращения мышц, проведения нервного импульса, протекания многих биохимических реакций и т.п. В покое расходуется 28 г (1 унция) АТФ в минуту, что эквивалентно 1,4 кг (3 фунта) в час, а при физической нагрузке расход АТФ достигает 0,5 кг в минуту! АТФ состоит из аденина, рибозы и трех фосфатных групп, которые называются а-, β- и у-фосфатными группами (рис. 10.1). Гидролиз высокоэнергетических фосфоангидридных связей между β- и у-атомами фосфора или между а- и β-атомами фосфора высвобождает энергию, необходимую для проведения биохимических реакций, т.е. для поддержания жизни организма.
Самый энергетически выгодный метод синтеза АТФ — это аэробное окислительное фосфорилирование. Однако АТФ может также образоваться в анаэробных условиях, хотя и с меньшей эффективностью. Существует три способа анаэробного синтеза АТФ: субстратное фосфорилирование, образование АТФ из фосфокреатина и в результате аденилаткиназной реакции. Хотя анаэробный синтез АТФ и не так энергетически выгоден, способность синтезировать АТФ в бескислородной среде может иметь жизненно важное значение.
На рис. 10.2 показано, что АТФ образуется в процессе гликолиза в ходе фосфоглицераткиназной и пируваткиназной реакций, а также в цикле Кребса в ходе реакции, катализируемой ферментом сукцинил-КоА-синтетазой с участием нуклеозидцифосфаткиназы (рис. 10.3). Примечание: для этих реакций кислород не требуется.
Рис. 10.2. Образование АТФ в ходе гликолиза путем субстратного фосфорилирования
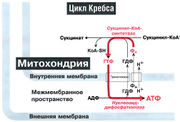
Рис. 10.3. В цикле Кребса путем субстратного фосфорилирования образуется ГТФ, который затем под действием нуклеозиддифосфаткиназы превращается в АТФ
Фосфокреатин — это «аварийный запас» высокоэнергетического фосфата, который можно использовать для быстрого образования АТФ, необходимого для сокращения мышц в анаэробных условиях. Этот интенсивный механизм синтеза АТФ может в экстренных ситуациях спасти жизнь; однако запасы фосфокреатина расходуются очень быстро, всего за несколько секунд.
В периоды покоя, когда молекул АТФ много, креатинкиназа фосфорилирует креатин с образованием фосфокреатина. Особенно важна роль этой реакции в мышцах. Если вдруг требуется сделать резкий рывок, фосфокреатин фосфорилирует АДФ до АТФ, необходимого для сокращения мышц (рис. 10.4) По этой причине фосфокреатин еще называют «фосфаген».

Креатин — это аминокислота, не входящая в состав белков. Креатин синтезируется из аргинина и выводится с мочой в форме креатинина. Уровень креатинина в крови и клиренс креатинина используются для оценки скорости клубочковой фильтрации при нарушении работы почек. Примечание: не путайте креатин, креатинин и карнитин.
Эргогенные средства — это вещества, которые повышают скорость, силу или выносливость спортсмена. Многие из них опасны и запрещены к использованию. Мнения противоречивы, тем не менее многие ученые сходятся на том, что креатин — единственное эргогенное средство, для которого научно доказано его свойство повышать работоспособность как при спринтерских, так и при продолжительных нагрузках.
После того как АТФ гидролизуется для высвобождения энергии, необходимой для сокращения мышц, в клетках образуется и накапливается АДФ. Но АДФ тоже содержит энергоемкую а-фосфоангидридную связь (рис. 10.1). Природа изобретательна: эта энергия становится доступной после того, как в анаэробных условиях две молекулы АДФ под действием аденилаткиназы образуют АТФ (рис. 10.5) (раньше фермент аденилаткиназу называли миокиназой).

Митохондрия — это органелла, по размеру сопоставимая с бактериальной клеткой. Примечательно, что у митохондрии есть две мембраны. Наружная мембрана пронизана молекулами порина. Порины образуют каналы, по которым через мембрану могут проходить молекулы с массой менее 10 кДа. Внутренняя мембрана ПРАКТИЧЕСКИ непроницаема; она образует впячивания — кристы. Через внутреннюю мембрану свободно проходят только небольшие молекулы — вроде Н20 и NH3. Лишь немногие другие молекулы с помощью белков-переносчиков и челночных систем способны преодолеть этот барьер.
Считается, что митохондрия — пример эндосимбиоза. Внутренняя мембрана митохондрии с заключенным в ней содержимым когда-то была древней анаэробной бактерией, которая проникла в примитивную клетку на ранних этапах эволюции. Сохранились и следы прошлого: так, митохондрия имеет свою собственную ДНК (мтДНК), кодирующую 37 генов. 24 из них участвуют в трансляции мтДНК, остальные кодируют белки дыхательной цепи. Примечательно, что только 13 из всех белков митохондриальной дыхательной цепи (а всего их более 85) закодированы в мтДНК. Остальные кодирует ядерная ДНК, и они транспортируются в митохондрию из цитоплазмы.

Дыхательная цепь — эффективный путь получения АТФ с использованием НАДН и ФАДН2, которые образуются в процессе окисления метаболического «топлива» [прежде всего углеводов и жирных кислот]. Дыхательная цепь состоит из пяти комплексов — I, II, III, IV и сложного комплекса грибовидной формы (комплекс V). Грибовидный «мультикомплекс» состоит из субъединиц F1 (субъединица «один») и F0 (субъединица «О», связывает олигомицин). Некоторые из комплексов дыхательной цепи содержат цитохромы, которые транспортируют электроны по цепи: комплекс III содержит цитохром b, а комплекс IV — цитохром а/аЗ. Кроме того, в транспорте электронов принимают участие убихинон (кофермент Q10) и цитохром С. Все комплексы дыхательной цепи расположены во внутренней мембране митохондрий. Комплексы I, III и IV не только переносят электроны, но также выполняют функцию молекулярных протонных насосов: они «выкачивают» протоны из матрикса в межмембранное пространство. Внутренняя мембрана непроницаема, в частности, она непроницаема для протонов, поэтому они возвращаются в матрикс только одним путем — через протонный канал комплекса F1/F0, который в этот момент синтезирует АТФ.
Поток электронов упрощенно показан на рис.
Существуют различные нарушения дыхательной цепи. Многие из них наследственно передаются по материнской линии, поскольку все митохондрии зиготы происходят из митохондрий яйцеклетки. При делении клетки тысячи молекул мтДНК случайным образом распределяются между дочерними клетками, поэтому разные ткани могут содержать как нормальные, так и мутантные молекулы мтДНК (это состояние называется гетероплазмией). Вследствие этого клиническая картина при таких патологиях очень изменчива. Мутации в ядерных генах, кодирующих белки дыхательной цепи, передаются по аутосомному типу и обычно вызывают более тяжелые нарушения.
Атрофия зрительного нерва Лебера вызывается мутацией участка митохондриальной ДНК, который кодирует одну из субъединиц комплекса I. От этого нарушения дыхательной цепи митохондрий сильнее всего страдает, по-видимому, зрительный нерв. Болезнь проявляется во взрослом возрасте и приводит к потере зрения.
Причина синдрома MELAS — мутация гена мтДНК, кодирующего лейциновую транспортную РНК митохондрий. Эта мутация влияет на трансляцию мтДНК, и поэтому при синдроме MELAS нарушена структура всех комплексов дыхательной цепи, кроме комплекса II, который полностью кодируется ядерным геномом.
Болезнь Ли — дегенеративное заболевание центральной нервной системы с характерными патологическими изменениями. Обычно развивается в раннем возрасте. Заболевание генетически гетерогенно: чаще всего причиной болезни являются мутации участков ядерных геномов, кодирующих компоненты дыхательной цепи, однако в некоторых случаях болезнь Ли развивается из-за мутаций митохондриальных генов. При болезни Ли может быть нарушена активность АТФ-синтетазы (комплекса V) или комплексов I, II, III, IV. При некоторых формах болезни Ли имеют место нарушения активности пируватдегидрогеназного комплекса.
Недостаточность пируватдегидрогеназного комплекса приводит к повышению в крови концентраций пирувата, лактата и аланина. У некоторых больных наблюдается улучшение состояния при приеме липоевой кислоты или тиамина (коферментов пируватдегидрогеназного комплекса). С ограниченным успехом применяется лечение кетогенной низкоуглеводной диетой. (Кетоновые тела легко проходят гематоэнцефалический барьер, и при их катаболизме образуется ацетил-КоА независимо от пируватдегирогеназного комплекса.)
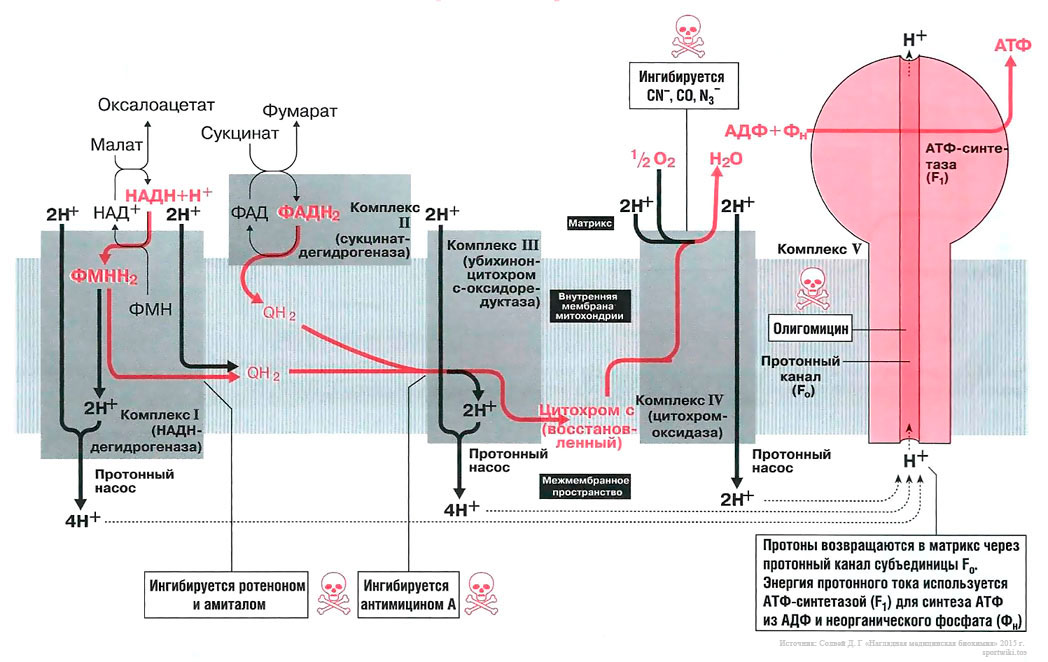
Биосинтез АТФ в дыхательной цепи, в котором принимает участие как поток электронов (е-), так и поток протонов (Н+), происходит путем окислительного фосфорилирования. Дыхательная цепь состоит из четырех комплексов (I, II, III, IV) и структуры грибовидной формы — АТФ-синтаза с субъединицами F0/F1 или комплекса V, который синтезирует АТФ из АДФ и неорганического фосфата (Фн). Ниже будет рассмотрено, как создается поток электронов и протонов в дыхательной цепи: первый начинается от комплекса I, второй — от комплекса II.
Поток электронов начинается от НАДН. Энергия для синтеза АТФ возникает благодаря разделению зарядов в комплексе I, которое вызывает движение электронов (электрический ток) и протонов (протонный ток). Молекулярный насос комплекса I выкачивает четыре протона в межмембранное пространство. Другие комплексы (III и VI) тоже выкачивают протоны в межмембранное пространство, и образуется электрохимический градиент протонов; в конечном итоге все эти протоны возвращаются обратно через протонный канал АТФ-синтазы (см. ниже). В комплексе I электроны переносятся с НАДН на убихинон (кофермент Q). Два электрона и два протона восстанавливают убихинон до убихинола (QH2), и убихинол движется в толще мембраны к комплексу III.
Поток протонов начинается от ФАДН2. Комплекс II содержит ФАД в виде простетических групп нескольких дегидрогеназ (например, сукцинатдегидрогеназы). Этот ФАД восстанавливается до ФАДН2. Далее комплекс II передает электроны убихинону (Q) для последующего переноса электронов к комплексу III. Примечание, комплекс II не выкачивает протоны.
В роли донора электронов выступает убихинол QH2, который при этом окисляется до убихинона Q и в этом виде может возвращаться обратно и принимать следующую пару электронов и протонов. Убихинол передает электроны на цитохром, который транспортирует их в комплекс IV. Протонный насос комплекса III выбрасывает 4 протона в межмембранное пространство.
Электроны, поступившие от цитохрома с, передаются кислороду, и кислород полностью восстанавливается с образованием воды. Комплекс IV выбрасывает в межмембранное пространство только 2 протона.
Этот комплекс состоит из «ножки гриба» — субъединицы F0, содержащей протонный канал, и из «выпуклой части» — АТФ-синтазы (или F1). Субъединица F0 получила свое название благодаря тому, что она ингибируется олигомицином, а субъединица F1 была первой открытой и выделенной «фракцией» среди всех элементов дыхательной цепи. Поток протонов проходит через протонный канал и запускает молекулярный двигатель, который заставляет АДФ и Фн реагировать друг с другом, образуя молекулы АТФ.
Примерно 2% электронов высвобождаются из дыхательной цепи и связываются непосредственно с кислородом, образуя активные формы кислорода (АФК). Если работа дыхательной цепи нарушена, АФК образуются в большем количестве. Эти вещества повреждают митохондрии, вызывая все большие нарушения дыхательной цепи. Возникает порочный круг, и в результате из-за накопления различных повреждений под действием АФК происходит старение клетки.
Вещества, которые ингибируют образование АТФ, потенциально токсичны для организма.
Амитал и ротенон блокируют транспорт электронов в комплексе I. Ротенон выделяют из корней растения деррис (Derris scandens) и нередко используют в качестве природного пестицида. Он малотоксичен для человека, поскольку плохо всасывается в желудочно-кишечном тракте. Однако ротенон ядовит для рыб, так как быстро всасывается через жабры. К тому же при долговременном воздействии ротенон опасен и для человека, так как вызывает развитие болезни Паркинсона.
Антимицин блокирует транспорт электронов в комплексе III.
Цианиды(CN-), угарный газ (СО) и азиды (N3-) ингибируют комплекс IV. Поэтому при отравлении цианидом блокируются аэробные метаболические процессы, несмотря на то что кровь достаточно насыщена кислородом. Из-за остановки аэробного метаболизма венозная кровь принимает цвет артериальной крови. Кроме того, наблюдается гипервентиляция, поскольку из-за накопления молочной кислоты стимулируется дыхательный центр.
Олигомицин блокирует протонный канал (F0 в комплексе V) и не дает протонам возвращаться в матрикс. Поэтому АТФ-синтаза (F1) теряет способность синтезировать АТФ.

На рис. 13.1 показан поток электронов и протонов в дыхательной цепи. Электроны и протоны от НАДН+ через комплекс I и от ФАДН2 через комплекс II передаются комплексу III. Затем электроны транспортируются в комплекс IV, где они присоединяются к кислороду. В это время протоны выкачиваются протонными насосами из матрикса в межмембранное пространство и возвращаются обратно в матрикс через протонный канал F0-субъединицы АТФ-синтазы (комплекс V). Поток протонов (протонный ток) включает молекулярным двигатель — F1-субъединицу АТФ-синтазного комплекса, и она располагает молекулы АДФ и Фн таким образом, что они объединяются в молекулы АТФ.
PGC-1α — тренер митохондрий

Наши мышцы обладают удивительной способностью приспосабливаться к интенсивности работы, которую на них возлагают. Канадские ученые сделали очередной шаг в понимании механизма такой адаптации. Теперь мы знаем, что когда мы совершаем легкую утреннюю пробежку или катаемся на коньках, в наших мышцах небольшой белок PGC-1α перемещается из цитоплазмы в митохондрии, активируя гены, необходимые для обеспечения нас энергией.
Гиподинамия — один из факторов риска развития сердечнососудистых заболеваний, диабета 2-го типа, ожирения и гипертонии — заболеваний, которые получили широкое распространение в современном мире. Результаты клинических исследований показывают, что физическая активность (особенно выполнение упражнений на выносливость) снижает риск развития хронических заболеваний и продлевает жизнь. Оказалось, что это связано с балансом энергетического метаболизма. Как известно, за получение энергии в наших клетках отвечают митохондрии. При длительной физической нагрузке в клетках сердечной и скелетных мышц, мозга, печени и жировой ткани увеличивается количество митохондрий. Это хорошо известный феномен, и его молекулярные основы сейчас интенсивно изучаются.
Для создания и работы митохондрии требуется около 1500 различных белков. Хотя эти органеллы и обладают собственным геномом, часть необходимых белков закодирована в ядре. Следовательно, чтобы собрать митохондрию, необходимо координировать экспрессию ядерных и митохондриальных генов.
Регуляция экспрессии генов — работа белков, которые называются факторами транскрипции. Они могут связываться с регуляторными областями генов (промоторами), способствуя посадке на них фермента РНК-полимеразы, которая и синтезирует мРНК, по которой затем будет синтезирован белок.
Факторы транскрипции работают не в одиночку, им нужно множество белков-помощников. Один из них — PGC-1α. Известно, что при выполнении физических упражнений количество этого белка в клетке увеличивается, и он перемещается из цитоплазмы в ядро. PGC-1α запускает экспрессию ряда факторов транскрипции. Затем они активируют гены ядерного и митохондриального генома, необходимые для построения митохондрии.
Недавно выяснилось, что PGC-1α может проникать не только в ядро, но и в митохондрии, где он мог бы участвовать в активации генов митохондриального генома. У митохондрии есть специальный фактор транскрипции — Tfam, который активирует только гены митохондриального генома. До сих пор не известно никаких белков, которые бы помогали ему в этом процессе. Поэтому логично проверить, не окажется ли PGC-1α белком-коактиватором Tfam.
Исследователи из Канады, чья работа опубликована в недавно вышедшем номере Journal of Biological Chemistry, решили изучить роль транспорта PGC-1α в митохондрию при выполнении физической нагрузки.
Исследователи разделили мышей на три группы. Первая была контрольная (SED, от sedentary, «малоподвижный»), мыши из этой группы вели малоподвижный образ жизни — сидели в своих клетках. Мыши из второй (END, от endurance, «выносливость») и третьей (END+3) группы совершали интенсивную физическую работу — бегали по беговой дорожке со скоростью 15 м/мин. в течение 90 минут. К концу этого времени мыши были практически обессилены. Мыши из группы END сразу же отправлялись на экспериментальные процедуры, а мышам из группы END+3 давали перед этим 3 часа, чтобы восстановиться.
Оказалось, что у мышей в группах END и END+3 (то есть после нагрузки) повышена экспрессия митохондриальных и ядерных генов (рис. 2). Среди них были гены различных субъединиц НАДН-дегидрогеназы, цитратсинтазы, цитохрома с, а также некоторые другие. Общее для этих белков — то, что все они обеспечивают получение энергии в митохондриях.
Кроме того, увеличилась экспрессия митохондриального фактора транскрипции Tfam и коактиватора PGC-1α. Таким образом, при увеличении физической нагрузки мышцы стремятся приспособиться к возросшим энергетическим потребностям, увеличив количество ферментов, использующихся при получении энергии.
Чем обусловлено такое усиление экспрессии? Не может ли в этом процессе принимать участие PGC-1α? Исследовав количество этого белка до (мыши группы SED) и после (мыши группы END и END+3) нагрузки, ученые пришли к выводу, что его количество во время нагрузки не меняется. Это неудивительно, несмотря на то, что количество мРНК для белка увеличилось. Такой механизм, когда мРНК запасается в клетке до определенного момента, хорошо известен.
Значит, если PGC-1α и участвует в изменении экспрессии, то каким-то другим способом. Например, общее количество белка в клетке может не меняться, но он может просто перераспределяться между разными частями клетки. Ранее уже было показано, что PGC-1α обнаруживается в митохондриях, но какую роль он там играет, было неясно.
Поэтому ученые проверили содержание белка в митохондриях и в ядрах у мышей из разных групп (рис. 3). Оказалось, что количество белка в этих органеллах существенно увеличивается сразу после нагрузки (группа END), а также продолжает расти после нее (группа END+3). Следовательно, миграция PGC-1α в ядро и в митохондрии может быть причиной активации генов в ответ на физическую нагрузку.
Однако сам по себе PGC-1α — не фактор транскрипции, а его помощник. Известно, что у митохондрии есть свой собственный фактор транскрипции Tfam. Ученые предположили, что PGC-1α может связываться с Tfam и таким образом участвовать в активации экспрессии генов митохондрии. Оказалось, что в клетках мышей из группы END и END+3 количество белка PGC-1α, взаимодействующего с Tfam, увеличивается. Следовательно, PGC-1α может взаимодействовать с фактором транскрипции Tfam, усиливая его активность.

В итоге складывается следующая картина. Когда клетки мышц заняты длительной физической работой, их энергетические потребности увеличиваются. Клетки пытаются приспособиться к новым условиям. Для этого им необходимо увеличить количество митохондрий или количество ферментов, обеспечивающих синтез АТФ в уже существующих митохондриях. Следовательно, необходимо активировать экспрессию генов, причем как в ядре, так и в митохондриях. Поэтому PGC-1α перемещается в ядро и в митохондрии, где помогает факторам транскрипции активировать работу генов. Таким образом, PGC-1α является частью механизма, помогающего мышцам адаптироваться к длительным нагрузкам.
Какова природа сигналов, заставляющих PGC-1α перемещаться в митохондрию и ядро? Ученые предполагают, что это, во-первых, какая-либо модификация белка. Например, фосфорилирование под действием клеточных киназ. Сами эти киназы могут активироваться активными формами кислорода. А, как известно, при интенсивной работе увеличивается скорость дыхания митохондрий, что приводит к увеличению количества активных форм кислорода.
Еще один вопрос связан с механизмом проникновения PGC-1α в митохондрию. Через ее мембраны могут проходить белки, имеющие специальную сигнальную последовательность. В PGC-1α ее обнаружено не было. Однако, возможно, PGC-1α может цепляться к белкам, у которых такой сигнал есть, и таким образом проникать в органеллу.
Все эти вопросы имеют не только чисто научное значение. Сегодня PGC-1α рассматривается как одна из мишеней для лечения заболеваний, связанных с митохондриями. Например, небольшое увеличение экспрессии PGC-1α в мышцах приводит к ослаблению атрофии, облегчает течение мышечной дистрофии Дюшенна, болезни Паркинсона и Хантингтона. Кроме того, PGC-1α способствует сохранению нервно-мышечных синапсов, снижению жировых отложений и воспаления, помогает поддерживать в норме уровень глюкозы и инсулина в крови. Следовательно, нарушение локализации PGC-1α может быть связано со всеми подобными патологиями.
В будущем, когда для лечения болезней будет опробована генная терапия с использованием PGC-1α, возникнет проблема его правильной локализации. И тогда, возможно, именно физические упражнения могут быть единственным и достаточно безопасным способом достигнуть этого эффекта.
Источник: Adeel Safdar, Jonathan P. Little, Andrew J. Stokl, Bart P. Hettinga, Mahmood Akhtar, Mark A. Tarnopolsky. Exercise Increases Mitochondrial PGC-1α Content and Promotes Nuclear-Mitochondrial Cross-talk to Coordinate Mitochondrial Biogenesis // Journal of Biological Chemistry. 2011. V. 286 (12). P. 10605–10617.
10. Митохондрии. Атф.
Митохондрии - микроскопические двумембранные полуавтономные органоиды общего назначения, обеспечивающие клетку энергией, получаемой благодаря процессам окисления и запасаемой в виде фосфатных связей АТФ. Митохондрии также участвуют в биосинтезе стероидов, окислении жирных кислот и синтезе нуклеиновых кислот. Присутствуют во всех эукариотических клетках. В прокариотических клетках митохондрий нет, их функцию выполняют мезосомы - впячивания наружной цитоплазматической мембраны внутрь клетки.
Митохондрии могут иметь эллиптическую, сферическую, палочковидную, нитевидную и др. формы, которые могут изменяться в течение определенного времени. Количество митохондрий в клетках, выполняющих различные функции, варьирует в широких пределах - от 50 и достигая в наиболее активных клетках 500-5000. Их больше там, где интенсивны синтетические процессы (печень) или велики затраты энергии (мышечные клетки). В клетках печени (гепатоцитах) их число составляет 800. а занимаемый ими объем равен примерно 20% объема цитоплазмы. Размеры митохондрий составляют от 0,2 до 1-2 мкм в диаметре и от 2 до 5-7 (10) мкм в длину. На светооптическом уровне митохондрии выявляются в цитоплазме специальными методами и имеют вид мелких зерен и нитей (что обусловило их название - от греч. mitos - нить и chondros - зерно).
В цитоплазме митохондрии могут располагаться диффузно, однако обычно они сосредоточены в участках максимального потребления энергии, например, вблизи ионных насосов, сократимых элементов (миофибрилл) органелл движения (аксонем спермия, ресничек), компонентов синтетического аппарата (цистерн ЭПС). Согласно одной из гипотез, все митохондрии клетки связаны друг с другом и образуют трехмерную сеть.
Митохондрия окружена двумя мембранами - наружной и внутренней, разделенных межмембранным пространством, и содержат митохондриальный матрикс, в который обращены складки внутренней мембраны - кристы.
Наружная митохондриальная мембрана гладкая, по химическому составу сходна с наружной цитоплазматической мембраной и обладает высокой проницаемостью для молекул массой до 10 килодальтон, проникающих из цитозоля в межмембранное пространство. По своему составу она похожа на плазмалемму, 25% составляют белки, 75% липиды. Среди липидов присутствует холестерол. Наружная мембранаа содержит много молекул специализированных транспортных белков (например, поринов), которые формируют широкие гидрофильные каналы и обеспечивают ее высокую проницаемость, а также небольшое количество ферментных систем. На ней находятся рецепторы, распознающие белки, которые переносятся через обе митохондриальные мембраны в особых точках их контакта - зонах слипания.
Внутренняя мембрана имеет выросты внутрь - гребни или кристы, делящие матрикс митохондрии на отсеки. Кристы увеличивают площадь поверхности внутренней мембраны. Таким образом, внутреняя митохондриальная мембрана по площади превосходит наружную. Кристы расположены перпендикулярно или продольно длине митохондрии. Кристы по форме могут быть везикулярные, тубулярные или ламеллярные.
Химический состав внутренней мембраны митохондрий сходен с мембранами прокариот (например, в ней присутствует особый липид - кардиодипин и отсутствует холестерол). Во внутренней митохондриальной мембране преобладают белки, составляющие 75%. Во внутреннюю мембрану встроены белки трех типов (а) белки электрон-транспортной цепи (дыхательной цепи) - НАД'Н-дегидрогеназа и ФАД'Н дегидрогеназа - и другие транспортные белки, (б) грибовидные тельца АТФ-синтетазы (головки которых обращены в сторону матрикса) и (в) часть ферментов цикла Кребса (сукцинатдегидрогеназа). Внутренняя митохондриальная мембрана отличается чрезвычайно низкой проницаемостью, транспорт веществ осуществляется через контактные сайты. Низкая проницаемость внутренней мембраны для мелких ионов из-за высокого содержания фосфолипида
Митохондрии - полуавтономные органоиды клетки, т.к. содержат собственную ДНК, полуавтономную систему репликации, транскрипции и собственный белоксинтезируюший аппарат - полуавтономную систему трансляции (рибосомы 70S типа и т-РНК). Благодаря этому митохондрии синтезируют часть собственных белков. Митохондрии могут делиться независимо от деления клетки. Если из клетки удалить все митохондрии, то новые в ней не появятся. Согласно теории эндосимбиоза митохондрии произошли от аэробных прокариотических клеток, которые попали в клетку хозяина, но не переварились, вступили на путь глубокого симбиоза и постепенно, утратив автономность, превратились в митохондрии.
Митохондрии - полуавтономные органоиды, что выражается следующими признаками:
1) наличие собственного генетического материала (нити ДНК), что позволяет осуществлять синтез белка, а также позволяет самостоятельно делиться независимо от клетки;
2) наличие двойной мембраны;
3) пластиды и митохондрии способны синтезировать АТФ (для хлоропластов источник энергии - свет, в митохондриях АТФ образуется в результате окисления органических веществ).
Функции митохондрий:
1) Энергетическая - синтез АТФ (отсюда эти органоиды и получили название «энергетических станций клетки»):
При аэробном дыхание на кристах происходит окислительное фосфорилирование (образование АТФ из АДФ и неорганического фосфата за счет энергии, освободившейся при окислении органических веществ) и перенос электронов по электрон-транспортной цепи. На внутренней мембране митохондрии расположены ферменты, участвующие в клеточном дыхании;
2) участие в биосинтезе многих соединений (в митохондриях синтезируются некоторые аминокислоты, стероиды (стероидогенез), синтезируется часть собственных белков), а также накопление ионов (Са 2+ ), гликопротеидов, белков, липидов;
3) окисление жирных кислот;
4) генетическая - синтез нуклеиновых кислот (идут процессы репликации и транскрипции). Митохондриальная ДНК обеспечивает цитоплазматическую наследственность.
АТФ была открыта в 1929 году немецким химиком Ломанном. В 1935 году Владимир Энгельгардт обратил внимание на то, что мышечные сокращения невозможны без наличия АТФ. В период с 1939 под 1941 г. лауреат Нобелевской премии Фриц Липман доказал, что основным источником энергии для метаболической реакции является АТФ, и ввел в обращение термин "энергетически богатые фосфатные связи". Кардинальные изменения в изучении действия АТФ на организм произошли в середине 70-х годов, когда было обнаружено наличие специфических рецепторов на наружной поверхности клеточных мембран, чувствительных к молекуле АТФ. С тех пор интенсивно изучается триггерное (регуляторное) действие АТФ на различные функции организма
Аденозинтрифосфорная кислота (АТФ, аденинтрифосфорная кислота) — нуклеотид, играет исключительно важную роль в обмене энергии и веществ в организмах; в первую очередь соединение известно как универсальный источник энергии для всех биохимических процессов, протекающих в живых системах.
Химически АТФ представляет собой трифосфорный эфир аденозина, который является производным аденина и рибозы.
Пуриновое азотистое основание — аденин — соединяется β-N-гликозидной сзязью с 5'-углеродом рибозы, к которой последовательно присоединяются три молекулы фосфорной кислоты, обозначаемые соответственно буквами: α, β и γ.
АТФ относится к так называемым макроэргическим соединениям, то есть к химическим соединениям, содержащим связи, при гидролизе которых происходит освобождение значительного количества энергии. Гидролиз фосфоэфирных связей молекулы АТФ, сопровождаемый отщеплением 1 или 2 остатков фосфорной кислоты, приводит к выделению, по различным данным, от 40 до 60 кДж/моль.
Высвобождённая энергия используется в разнообразных процессах, протекающих с затратой энергии
1)Главная - энергетическая. АТФ служит непосредственным источником энергии для множества энергозатратных биохимических и физиологических процессов.
2) синтез нуклеиновых кислот.
3) регуляция множества биохимических процессов. АТФ, присоединяясь к регуляторным центрам ферментов, усиливает или подавляет их активность.
непосредственный предшественник синтеза циклоаденозинмонофосфата — вторичного посредника передачи в клетку гормонального сигнала.
медиатор в синапсах
пути синтеза:
В организме АТФ синтезируется из АДФ, используя энергию окисляющихся веществ:
Фосфорилирование АДФ возможно двумя способами: субстратное фосфорилирование и окислительное фосфорилирование. Основная масса АТФ образуется на мембранах в митохондриях путём окислительного фосфорилирования ферментом H-зависимой АТФ-синтетазой. Субстратное фосфорилирование АДФ не требует участия мембран, оно происходит в процессе гликолиза или путём переноса фосфатной группы с других макроэргических соединений.
Реакции фосфорилирования АДФ и последующего использования АТФ в качестве источника энергии образуют циклический процесс, составляющий суть энергетического обмена.
В организме АТФ является одним из самых часто обновляемых веществ. В течение суток одна молекула АТФ проходит в среднем 2000—3000 циклов ресинтеза (человеческий организм синтезирует около 40 кг в день), то есть запаса АТФ в организме практически не создаётся, и для нормальной жизнедеятельности необходимо постоянно синтезировать новые молекулы АТФ.
Читайте также:

